
【題目】二氧化錳是化學工業中常用的氧化劑和有機合成中的催化劑,其主要制備方法是碳酸錳熱分解,反應原理為2MnCO3+ O2![]() 2MnO2+2CO2。經研究發現該反應過程為①MnCO3
2MnO2+2CO2。經研究發現該反應過程為①MnCO3![]() MnO+ CO2;②2MnO +O2
MnO+ CO2;②2MnO +O2![]() 2MnO2。
2MnO2。
回答下列問題:
(1)某溫度下該平衡體系的壓強為P,CO2、O2的物質的量分別為n1和n2,用平衡分壓代替平衡濃度,碳酸錳熱分解反應的平衡常數K=________(分壓=總壓×物質的量分數);K與反應①、②的平衡常數K1、K2的關系為_________________。
(2)反應②在低溫下能自發進行,則其△H__________0 (填“>”、“<”或“=”)。
科目:高中化學 來源: 題型:
【題目】原子核磁共振譜(NMR)是研究有機化合物結構的有力手段之一,在所研究化合物的分子中,每一結構中的等性氫原子,在NMR譜中都給出了相應的峰(信號),譜中峰的強度與結構中的氫原子數成正比。例如,乙醛的結構式為 ,其NMR中有兩個峰,強度之比為3∶1。
,其NMR中有兩個峰,強度之比為3∶1。
(1)結構簡式為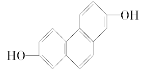 的有機物,在NMR上觀察峰的強度之比為________________。
的有機物,在NMR上觀察峰的強度之比為________________。
(2)實踐中可根據NMR上觀察到的氫原子給出的峰值情況,確定有機物的結構。如分子式為C3H6O2的鏈狀有機物,其NMR上峰給出的穩定強度僅有4種,它們分別為:①3∶3;②3∶2∶1;③3∶1∶1∶1;④2∶2∶1∶1,請分別推斷出其對應的全部結構:
①________________________________,
②________________________________,
③________________________________,
④________________________________。
(3)測得化合物CH3CH2CH2CH3的NMR上可觀察到兩種峰,而測得CHCH3CHCH3時,卻得到氫原子給出的信號峰4個,結合其空間結構解釋產生4個信號峰的原因:_______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用中和滴定法測定某鹽酸的物質的量濃度。
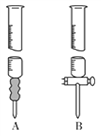
(1)標準溶液應盛于___________(填“A”或“B”)滴定管中。
(2)若選用酚酞作指示劑,以0.1250 mol·L-1的標準氫氧化鈉溶液滴定,如何判斷滴定終點____________。
(3)實驗數據記錄如下表,請分析數據并計算,鹽酸的物質的量濃度=_________mol·L-1。
滴定次數 | 待測溶液體積/mL | ||
標準堿液 | |||
滴定前讀數/mL | 滴定后讀數/mL | ||
1 | 20.00 | 0.00 | 16.02 |
2 | 20.00 | 0.00 | 15.98 |
3 | 20.00 | 0.00 | 16.00 |
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各表中的數字代表的是元素的原子序數,表中數字所表示的元素與它們在周期表中的相對位置相符的是
( )
A.
3 | 5 | |
13 | ||
20 |
B.
1 | ||
4 | 5 | |
15 |
C.
1 | 2 | |
11 | ||
19 |
D.
8 | 10 | |
17 | ||
36 |
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.制備水楊酸對正辛基苯基酯(![]() )的過程如下:
)的過程如下:
步驟一:將水楊酸晶體投入到三頸燒瓶中,再加入適量的氯苯作溶劑并充分攪拌使晶體完全溶解,最后加入少量的無水三氯化鋁。
步驟二:按下圖所示裝置裝配好儀器,水浴加熱控制溫度在20~40℃之間,在攪拌下滴加SOCl2,反應制得水楊酰氯。
該反應方程式為:
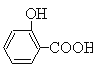 (水楊酸)+SOCl2→
(水楊酸)+SOCl2→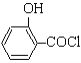 (水楊酰氯)+HCl↑+SO2↑
(水楊酰氯)+HCl↑+SO2↑
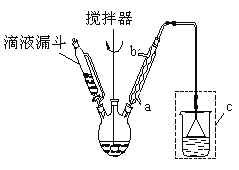
步驟三:將三頸燒瓶中混合液升溫至80℃,再加入對正辛苯酚[![]() ],溫度控制在100℃左右,不斷攪拌。
],溫度控制在100℃左右,不斷攪拌。
步驟四:過濾、蒸餾、減壓過濾;酒精洗滌、干燥即得產品。
(1)實驗時,冷凝管中的冷卻水進口為 _______(選填“a”或“b”);
(2)步驟一中加入無水三氯化鋁的作用是 ___________________________。
(3)步驟三中發生反應的化學方程式為 _____________________________。
Ⅱ.PCl3可用于半導體生產的外延、擴散工序。有關物質的部分性質如下:
熔點/℃ | 沸點/℃ | 密度/g·mL-1 | 其他 | |
白磷 | 44.1 | 280.5 | 1.82 | 2P(過量)+3Cl2 |
PCl3 | -112 | 75.5 | 1.574 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
POCl3 | 2 | 105.3 | 1.675 | 遇水生成H3PO4和HCl,能溶于PCl3 |
已知下圖是實驗室制備PCl3的裝置(部分儀器已省略),則:
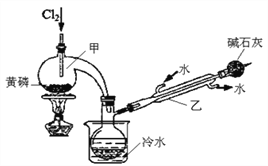
(1)實室制備Cl2的離子反應方程式為:________________。
(2)堿石灰的作用除了防止空氣中的O2和水蒸氣進入并與產品發生反應外還有:_________。
(3)向儀器甲中通入干燥Cl2之前,應先通入一段時間的干燥CO2,其目的是_____________。
(4)測定產品中PCl3純度的方法如下:迅速稱取m g產品,水解完全后配成500mL溶液,取出25.00mL加入過量的c1 mol/L V1 mL 碘溶液,充分反應后再用c2 mol/L Na2S2O3溶液滴定過量的碘,終點時消耗V2 mL Na2S2O3溶液。已知:H3PO3+H2O+I2==H3PO4+2HI;I2+2Na2S2O3==2NaI+Na2S4O6;假設測定過程中沒有其他反應,則根據上述數據,求出該產品中PCl3的質量分數為 ___________________(用含字母的代數式表示、可不化簡)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】軟錳礦的主要成分為MnO2,含少量Al2O3和SiO2。閃鋅礦主要成分為ZnS,含少量FeS、CuS、CdS雜質。現以軟錳礦和閃鋅礦為原料制備MnO2和Zn,其簡化流程如下(中間產物的固體部分已經略去)。

已知: Ⅰ.礦石中所有金屬元素在濾液A中均以離子形式存在。
Ⅱ.各種金屬離子完全沉淀的pH如下表:
Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
回答下列問題:
(1)步驟①中為了加快硫酸的浸取速率,可采用的方法是_________________(任寫一種)。①中發生多個反應,其中MnO2、FeS與硫酸共熱時有淡黃色物質析出,溶液變為棕黃色,寫出MnO2、FeS與硫酸共熱發生反應的化學方程式______________________。
(2)步驟②加入金屬鋅是為了回收金屬,回收金屬的主要成分是_________。
(3)步驟③中MnO2的其作用是__________________,另外一種物質X可以是__________。
A.ZnO B.MgCO3 C.MnCO3 D.Cu(OH)2
(4)MnO2與Li構成LiMnO2,它可作為某鋰離子電池的正極材料,電池反應方程式為: Li1-xMnO2+LixC6=LiMnO2+6C,寫出該鋰離子電池的正極電極反應式__________。
(5)已知:HCN的電離常數K=4.9×10-10,H2S的電離常數K1=1.3×10―7,K2=7.0×10―15,向NaCN溶液中通入少量的H2S氣體,反應的離子方程式為__________________。在廢水處理領域中常用H2S將Mn2+轉化為MnS除去,向含有0.020 mol·L―1Mn2+廢水中通入一定量的H2S氣體,調節溶液的pH=a,當HS―濃度為1.0×10―4 mol·L―1時,Mn2+開始沉淀,則a=______。[已知:Ksp(MnS)=1.4×10―15]
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】通式為CnH2n-2的某烴在定容密閉容器中與足量O2完全燃燒,若反應前后壓強不變(150℃),此烴分子式中n值為
A、2 B、3 C、4 D、5
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有A、B、C、D四種金屬,進行如下實驗:①將A與B浸在稀硫酸中用導線相連,A逐漸溶解,B上有氣泡逸出;②將A、D分別投入等濃度鹽酸中,D比A反應劇烈;③將B浸入C的鹽溶液里,有金屬C析出。據此判斷它們的活動性由強到弱的順序是
A.D>C>A>B B.D>A>B>C
C.D>B>A>C D.B>A>D>C
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com