
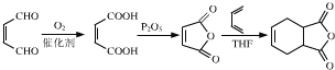
【題目】以下是以植物細胞中半纖維素木聚糖為原料合成鎮痛藥品莫沙朵林(G)的路線:

已知:①四氫呋喃結構式為 ![]() ,在流程中作反應的催化劑;
,在流程中作反應的催化劑;
②雙烯合成反應: ;
;
③ .
.
回答下列問題:
(1)B的化學式__;B中官能團的名稱_____;
(2)E→G的反應類型______
(3)C與新制氫氧化銅的懸濁液反應的化學方程式為________
(4)D和F的結構簡式分別是______、________
(5)寫出同時滿足下列條件的E的一種同分異構體的簡式________
①分子中含有苯環 ②能發生銀鏡反應 ③能與FeCl3溶液發生顯色反應
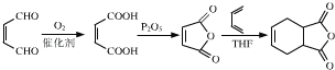
(6)有機物H(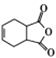 )是合成抗病毒藥物阿昔洛韋的中間體.參照上述合成路線,寫出以1,3﹣丁二烯為原料制備H的合成路線流程圖(無機試劑任用): ________
)是合成抗病毒藥物阿昔洛韋的中間體.參照上述合成路線,寫出以1,3﹣丁二烯為原料制備H的合成路線流程圖(無機試劑任用): ________
【答案】 C5H10O5 醛基、羥基 取代反應 ![]()
![]() CH3NHCOOH
CH3NHCOOH 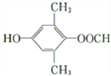
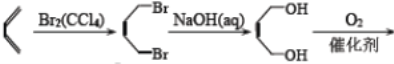
【解析】考查有機物的推斷和合成,(1)根據B的結構簡式,B的分子式為C5H10O5,含有的官能團是羥基和醛基;(2)根據G的結構簡式,推出化合物F的結構簡式為CH3NHCOOH,即E生成G的反應類型為酯化反應或取代反應;(3)C中含有醛基,與新制氫氧化銅懸濁液發生氧化反應,即化學方程式為![]() ;(4)根據E的結構簡式,生成E的反應類型為加成反應,即D的結構簡式為
;(4)根據E的結構簡式,生成E的反應類型為加成反應,即D的結構簡式為![]() ;F的結構簡式為CH3NHCOOH;(5)含有苯環,能發生銀鏡反應,說明含有醛基,能與氯化鐵發生顯色反應,說明含有酚羥基,因此符合條件的同分異構體有
;F的結構簡式為CH3NHCOOH;(5)含有苯環,能發生銀鏡反應,說明含有醛基,能與氯化鐵發生顯色反應,說明含有酚羥基,因此符合條件的同分異構體有 等;(6)根據信息③和上述合成路線,得出合成H的路線為
等;(6)根據信息③和上述合成路線,得出合成H的路線為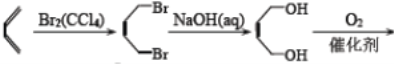
 。
。


 激活思維優加課堂系列答案
激活思維優加課堂系列答案 活力試卷系列答案
活力試卷系列答案科目:高中化學 來源: 題型:
【題目】下列反應既屬于氧化還原反應,又屬于吸熱反應的是( )
A.鋅片與稀硫酸反應
B.Ba(OH)2·8H2O與NH4Cl反應
C.灼熱的炭與CO2反應
D.甲烷在氧氣中的燃燒反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,向10mL 0.2mol/L草酸溶液中逐滴加入等濃度的NaOH溶液,溶液中各微粒的物質的量與混合溶液pH的關系如圖所示,下列說法正確的是
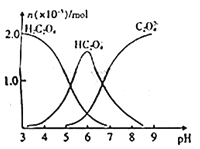
A. 當V(NaOH溶液)<10mL時,溶液中可能存在:c(Na+)=2c(C2O42-)+c(HC2O4-)
B. 當V(NaOH溶液)=10mL時,溶液中水的電離程度比純水大
C. 當V(NaOH溶液)=15mL時,溶液中存在: c(Na+)>c(HC2O4-)>c(C2O42-)
D. 當V(NaOH溶液)=20mL時,溶液中存在:c(OH-)=2c(H2C2O4)+c(H+)+c(HC2O4-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數的值,下列說法正確的是
A. 標準狀況下,11.2L HF 中含有氟原子的數目為0.5 NA
B. 2 mol SO2 和1mol O2 混合充分反應后,轉移電子的數目為4 NA
C. 46g NO2 和N2O4的混合物中含有氧原子的數目為2 NA
D. 1mol 乙醇分子中含有極性鍵的數目為8 NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】海洋中有豐富的食品、礦產、能源、藥物和水產資源。下圖是從海水中提取某些原料的流程圖。
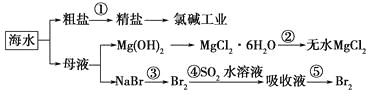
下列有關說法正確的是( )。
A. 第①步中除去粗鹽中的SO42—、Ca2+、Mg2+、Fe3+等雜質,加入的藥品順序為Na2CO3溶液―→NaOH溶液―→BaCl2溶液―→過濾后加鹽酸
B. 工業上通過氯堿工業制取金屬鈉
C. 從第③步到第⑤步的目的是濃縮、富集溴單質
D. 第②步的反應條件是高溫加熱
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列指定反應的離子方程式正確的是( )
A. MnO2與濃鹽酸混合加熱:MnO2+4H++2Cl﹣![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
B. 大理石與鹽酸反應:CO32﹣+2H+ = H2O+CO2↑
C. 向醋酸溶液中滴加NaOH溶液:OH-+H+![]() H2O
H2O
D. 漂白粉溶液吸收二氧化碳:Ca2++ CO2+ H2O = CaCO3↓+2H+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲醇(CH3OH )是一種用途廣泛的基礎有機原料和優質燃料。
(1)甲醇可以在銅作催化劑的條件下直接氧化成甲醛(HCHO)
①基態Cu原子的價層電子的軌道表達式為_____,其核外電子共占據_____個能級。
②甲醇和甲醛中碳原子的雜化方式分別為_____,其組成元素的電負性由小到大的順序為________.
(2)在一定條件下,甲醇(沸點64.7℃)可轉化為乙酸甲酯(CH3COOCH3,佛點57.1℃)
①乙酸甲酯分子中心鍵和節鍵的個數之比為_________;
②甲醇與乙酸甲酯的混合物因沸點接近而不易分離,工業上用蒸餾的方法分離二者時常先加適量水,理由為______________。
(3)科研團隊通過皮秒激光照射懸浮在甲醇溶液中的多臂碳納米管合成T一碳,T-碳的晶體結構可以看成金剛石晶體中每個碳原子被- 一個由四個碳原子組成的正四面體結構單元取代,如圖所示。
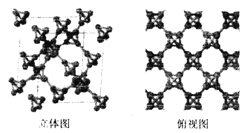
①T-碳與金剛石互稱為_________;一個T-碳晶胞中含有______個碳原子。
②T-碳的密度非常小,約為金剛石的一半。試計算T-碳晶胞的邊長和金剛石品胞的邊長之比為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
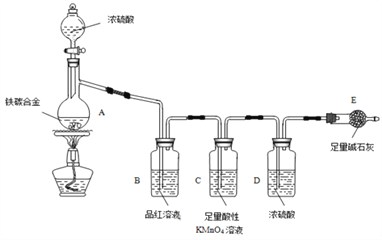
【題目】現有某鐵碳合金,某化學興趣小組為了測定鐵碳合金中鐵的質量分數,并探究濃硫酸的某些性質,設計了下圖所示的實驗裝置和實驗方案(夾持儀器已省略),請你參與此項活動并回答相應問題(由實驗裝置引起的實驗誤差忽略不計)。
I、探究濃硫酸的某些性質
(1)按圖示連接裝置,檢查裝置___________,稱量E的質量。
(2)將aɡ鐵碳合金樣品放入A中,再加入適量的濃硫酸,儀器A的名稱為______,未點燃酒精燈前,A、B 均無明顯現象,其原因是______________________。
(3)點燃酒精燈一段時間后,A、B中可觀察到明顯的現象,如A中![]() ,寫出A中C和濃硫酸發生反應的化學方程式:__________________________,B中的現象是_________________,因此可得到濃硫酸具有_____________性。
,寫出A中C和濃硫酸發生反應的化學方程式:__________________________,B中的現象是_________________,因此可得到濃硫酸具有_____________性。
(4)隨著反應的進行,濃硫酸濃度逐漸減小變為稀硫酸,A中還可能發生某些離子反應,寫出相應的離子方程式:_________________、____________________。
II、測定鐵的質量分數
(5)待A中固體完全消失并不再逸出氣體時,停止加熱,拆下E并稱重,E增重bg。鐵碳合金中鐵的質量分數為___________________(寫表達式)。
(6)某同學認為上述方法較復雜,使用如圖所示的裝置和其他常用的實驗儀器測定某些數據即可。為了快速和準確地計算出鐵的質量分數,最簡便的實驗操作是___________(填寫代號)。

①用排水法測定H2的體積
②反應結束后,過濾、洗滌、干燥、稱量殘渣的質量
③ 測定反應前后裝置和藥品的總質量ag
【答案】氣密性 蒸餾燒瓶 常溫下,鐵被濃硫酸鈍化 C+2H2SO4(濃)![]() CO2↑+2SO2↑+2H2O 品紅溶液逐漸褪色 強氧化 2Fe3++Fe=3Fe2+ Fe+2H+=Fe2++H2↑
CO2↑+2SO2↑+2H2O 品紅溶液逐漸褪色 強氧化 2Fe3++Fe=3Fe2+ Fe+2H+=Fe2++H2↑ ![]()
③
【解析】
(1)按圖示連接好裝置以后,首先檢查裝置的氣密性:(2)根據儀器構造可知儀器A的名稱為蒸餾燒瓶;常溫下Fe在濃硫酸中鈍化,碳不與濃硫酸反應,故無明顯現象;(3)濃硫酸具有強氧化性,在加熱的條件下碳與濃硫酸反應的方程式為C+2H2SO4(濃)![]() CO2↑+2SO2↑+2H2O;二氧化硫具有漂白性,因此B中的現象是品紅溶液逐漸褪色,根據以上分析可知濃硫酸具有強氧化性;(4)硫酸濃度減小后,稀硫酸與鐵發生置換反應生成硫酸亞鐵和氫氣,另外鐵還能與硫酸鐵反應生成硫酸亞鐵,離子方程式分別為Fe+2H+=Fe2++H2↑、2Fe3++Fe=3Fe2+;(5)稱取ag鐵碳合金,加入過量濃硫酸,加熱待A中不再逸出氣體時,停止加熱,拆下E裝置并稱重,E增重bg,則生成二氧化碳的質量為bg,根據質量守恒定律,則ag鐵碳合金中含碳元素的質量為
CO2↑+2SO2↑+2H2O;二氧化硫具有漂白性,因此B中的現象是品紅溶液逐漸褪色,根據以上分析可知濃硫酸具有強氧化性;(4)硫酸濃度減小后,稀硫酸與鐵發生置換反應生成硫酸亞鐵和氫氣,另外鐵還能與硫酸鐵反應生成硫酸亞鐵,離子方程式分別為Fe+2H+=Fe2++H2↑、2Fe3++Fe=3Fe2+;(5)稱取ag鐵碳合金,加入過量濃硫酸,加熱待A中不再逸出氣體時,停止加熱,拆下E裝置并稱重,E增重bg,則生成二氧化碳的質量為bg,根據質量守恒定律,則ag鐵碳合金中含碳元素的質量為![]() ,則含鐵的質量為
,則含鐵的質量為![]() ,鐵的質量分數為
,鐵的質量分數為![]() ;(6)因為鐵炭合金中的鐵可以與稀硫酸反應生成氫氣,瓶總質量的減少量即為氫氣的生成量,而鐵的質量可以通過氫氣的質量求出,答案選③。
;(6)因為鐵炭合金中的鐵可以與稀硫酸反應生成氫氣,瓶總質量的減少量即為氫氣的生成量,而鐵的質量可以通過氫氣的質量求出,答案選③。
【題型】實驗題
【結束】
29
【題目】現有一種銅粉和鋁粉的混合物樣品,為測定該樣品中鋁的含量,稱取5.0g此樣品置于錐形瓶中,將100mL稀鹽酸加入其中恰好完全反應,剩余固體2.3g.
(1)求該混合物中鋁的質量分數為多少?
(2)所用鹽酸中溶質的物質的量濃度為多少?
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com