
【題目】下列電離方程式中,不正確的是( )
A.HCl═H++Cl﹣
B.NH3H2O═NH4++OH﹣
C.CaCl2=Ca2++2Cl﹣
D.CH3COOHCH3COO﹣+H+
科目:高中化學 來源: 題型:
【題目】為了除去KCl固體中少量的MgCl2、MgSO4,可選用Ba(OH)2、鹽酸和K2CO3三種 試劑,按如下步驟操作:
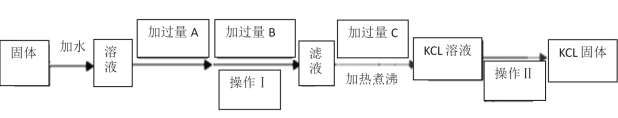
(1)圖中三種試劑分別為:A__________________、 B__________________、 C___________________。
(2)加入過量A的目的是______________________________________________________________________;
加入過量B的目的是______________________________________________________________________;
加熱煮沸的目的是______________________________________________________________________;
(3)操作Ⅱ的名稱是______________________________。
(4)檢驗得到的KCl中不含有SO42-的操作________________________________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用酸性甲醛燃料電池為電源進行電解的實驗裝置如圖所示,下列說法中正確的是

A. 當a、b都是銅作電極時,電解的總反應方程式為2CuSO4+2H2O![]() 2H2SO4+2Cu+O2↑
2H2SO4+2Cu+O2↑
B. 燃料電池工作時,正極反應為O2+2H2O+4e-===4OH-
C. 當燃料電池消耗22.4 L甲醛氣體時,電路中理論上轉移2 mol e-
D. 燃料電池工作時,負極反應為HCHO+H2O-2e-===HCOOH+2H+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】乙炔(CH≡CH)是重要的化工原料,廣泛應用于焊割、燃料電池及有機合成等。
(1)乙炔-空氣燃料電池是一種堿性(20%-30%的KOH溶液)燃料電池。電池放電時,負極的電極反應式為_____________;
(2)科學家利用“組合轉化技術”,將乙炔燃燒產物CO2轉化成乙烯,反應式為:6H2(g)+2CO2(g)![]() CH2=CH2(g)+4H2O(g)下圖為溫度對CO2平衡轉化率、催化劑催化效率的影響。下列說法正確的是_____(填序號)
CH2=CH2(g)+4H2O(g)下圖為溫度對CO2平衡轉化率、催化劑催化效率的影響。下列說法正確的是_____(填序號)
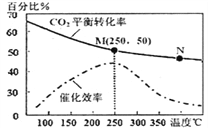
①250℃時,催化劑的催化效率最大
②隨著溫度升高,乙烯的產率增大
③M點平衡常數比N點平衡常數大
④N點正反應速率一定大于M點正反應速率
⑤增大壓強可提高乙烯的體積分數
(3)甲烷裂解法制取乙炔的反應方程式為:2CH4(g)![]() C2H2(g)+3H2(g)。已知:
C2H2(g)+3H2(g)。已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H1= a kJ·mol-1
C2H2(g)+2.5O2(g)=2CO2(g)+H2O(l) △H2= b kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H3= c kJ·mol-1
則2CH4(g)![]() C2H2(g)+3H2(g) △H=______kJ·mol-1
C2H2(g)+3H2(g) △H=______kJ·mol-1
(4)哈斯特研究發現:甲烷裂解時,幾種氣體平衡時分壓(Pa)與溫度(℃)之間的關系如圖所示。甲烷裂解可能發生的反應有:2CH4(g)![]() C2H2(g)+3H2(g),2CH4(g)
C2H2(g)+3H2(g),2CH4(g)![]() C2H4(g)+2H2(g)。
C2H4(g)+2H2(g)。
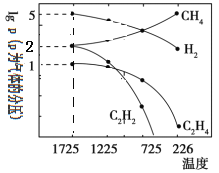
①1725℃時,向1L恒容密閉容器中充入0.3molCH4,達到平衡時,測得c(C2H2)=c(CH4)。則CH4生成C2H2的平衡轉化率為_______;
②1725℃時,反應2CH4(g)![]() C2H2(g)+3H2(g)的平衡常數Kp=_________(用平衡分壓代替平衡濃度);
C2H2(g)+3H2(g)的平衡常數Kp=_________(用平衡分壓代替平衡濃度);
③由圖可知,甲烷裂解制乙炔有副產物乙烯生成。為提高甲烷制乙炔的產率,除改變溫度外,還可采取的措施有_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】《茉莉花》是一首膾炙人口的江蘇民歌。茉莉花香氣的成分有多種,乙酸苯甲酯![]() 是其中的一種,它可以從茉莉花中提取,也可以用甲苯和乙醇為原料進行人工合成。一種合成路線如下:
是其中的一種,它可以從茉莉花中提取,也可以用甲苯和乙醇為原料進行人工合成。一種合成路線如下:
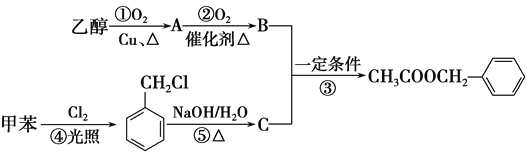
(1)B、C的結構簡式分別為______________、________________。
(2)寫出反應①、④的化學方程式:
①_____________________;④______________________。
(3)反應③、⑤的反應類型分別為③________,⑤____________。
(4)反應________(填序號)原子的理論利用率為100%,符合“綠色化學”的要求。
(5)乙酸苯甲酯的同分異構體中能與碳酸氫鈉反應生成氣體的有________種。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)分別寫出乙醛與銀氨溶液、苯酚鈉溶液中通入少量CO2反應的離子方程式:__________________________________、__________________________________。
(2)乙烯是一種重要的化工原料,以乙烯為原料衍生出部分化工產品的反應如下(部分反應條件已略去):請回答下列問題:

(1)A的化學名稱是_____;
(2)B和A反應生成C的化學方程式為________,該反應的類型為_____________
(3)D(環狀化合物)的結構簡式為___________;
(4)F的結構簡式為_____________;
(5)D的同分異構體的結構簡式為___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】科學家對一碳化學進行了廣泛深入的研究并取得了一些重要成果。
(1)已知:CO(g)+2H2(g)![]() CH3OH(g) ΔH1=-90.1kJ·mol-1;
CH3OH(g) ΔH1=-90.1kJ·mol-1;
3CH3OH(g)![]() CH3CH=CH2(g)+3H2O(g) ΔH2=-31.0 kJ·mol-1。
CH3CH=CH2(g)+3H2O(g) ΔH2=-31.0 kJ·mol-1。
CO與H2合成CH3CH=CH2的熱化學方程式為______________________________________。
(2)現向三個體積均為2L的恒容密閉容器Ⅰ、Ⅱ、Ⅲ中,均分別充入1molCO和2molH2,發生反應:CO(g)+2H2(g)![]() CH3OH(g) ΔH=-90.1kJ·mol-1。三個容器的反應溫度分別為T1、T2、T3且恒定不變。當反應均進行到5min時H2的體積分數如圖1所示,其中只有一個容器中的反應已經達到平衡狀態。
CH3OH(g) ΔH=-90.1kJ·mol-1。三個容器的反應溫度分別為T1、T2、T3且恒定不變。當反應均進行到5min時H2的體積分數如圖1所示,其中只有一個容器中的反應已經達到平衡狀態。
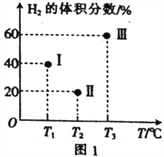
①5min時三個容器中的反應達到化學平衡狀態的是容器_____________(填序號)。
②0~5min內容器Ⅰ中用CH3OH表示的化學反應速率v(CH3OH)=_________________。
③當三個容器中的反應均達到平衡狀態時,CO的轉化率最高的是容器____________(填序號,下同);平衡常數最小的是容器____________________。
(3)CO常用于工業冶煉金屬,在不同溫度下用CO還原四種金屬氧化物,達到平衡后氣體中lg![]() 與溫度(T)的關系如圖2所示。下列說法正確的是_____________(填字母)。
與溫度(T)的關系如圖2所示。下列說法正確的是_____________(填字母)。
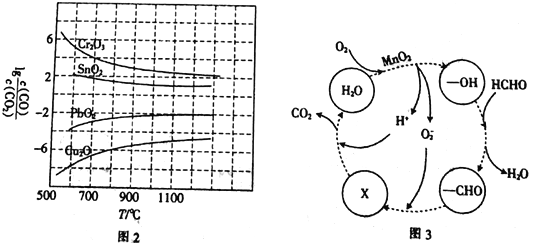
a.工業上可以通過增高反應裝置來延長礦石和CO接觸的時間,減少尾氣中CO的含量
b.CO用于工業冶煉金屬鉻(Cr)時,還原效率不高
c.工業冶煉金屬銅(Cu)時,600℃下CO的利用率比100℃下CO的利用率更大
d.CO還原PbO2反應的ΔH>0
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關下圖中有機物的說法不正確的是
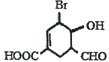
A. 該有機物的分子式為C8H9O4Br
B. 1mol該有機物最多可以與3molH2反應
C. 能發生酯化反應、水解反應、銀鏡反應和縮聚反應
D. 1mol該有機物與NaOH溶液反應時,最多消耗2molNaOH
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com