
【題目】在一定溫度下,容器內某一反應中M、N的物質的量隨反應時間變化的曲線如下圖所示,下列表述不正確的是

A. 反應的化學方程式為:3N ![]() 2M
2M
B. t2時,正、逆反應速率不相等
C. t3時,正反應速率等于逆反應速率,達到平衡
D. t1時,N的濃度是M濃度的2倍
【答案】A
【解析】
A、由圖像可知:N是反應物、M是生成物,同一時間內物質的量的變化量比為系數比;B、t2時M、N的物質的量相等,但此時M、N的物質的量仍在變化,所以t2時沒有達到平衡狀態;C、t3后M、N的物質的量不再變化,說明達到平衡狀態;D、根據![]() 分析。
分析。
A、由圖像可知:N是反應物、M是生成物,同一時間內物質的量的變化量比為系數比,所以反應方程式是2N ![]() M,故A錯誤;B、t2時M、N的物質的量相等,但此時M、N的物質的量仍在變化,所以t2時沒有達到平衡狀態,正、逆反應速率不相等,故B正確;C、t3后M、N的物質的量不再變化,說明達到平衡狀態,正反應速率等于逆反應速率,故C正確;D、t1時,N、M的物質的量分別是6mol、3mol,根據
M,故A錯誤;B、t2時M、N的物質的量相等,但此時M、N的物質的量仍在變化,所以t2時沒有達到平衡狀態,正、逆反應速率不相等,故B正確;C、t3后M、N的物質的量不再變化,說明達到平衡狀態,正反應速率等于逆反應速率,故C正確;D、t1時,N、M的物質的量分別是6mol、3mol,根據![]() ,N的濃度是M濃度的2倍,故D正確。
,N的濃度是M濃度的2倍,故D正確。


 目標測試系列答案
目標測試系列答案科目:高中化學 來源: 題型:
【題目】(1)反應3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)在一容積可變的密閉容器中進行,試回答:
Fe3O4(s)+4H2(g)在一容積可變的密閉容器中進行,試回答:
①增加Fe的量,其反應速率____(填“增大”、“不變”或“減小”,下同)。
②將容器的體積縮小一半,其反應速率____。
③保持體積不變,充入He,其反應速率____。
④保持壓強不變,充入He,其反應速率_____。
(2)氨氣可作為脫硝劑,在恒溫恒容密閉容器中充入一定量的NO和NH3,在一定條件下發生反應:6NO(g)+4NH3(g)![]() 5N2(g)+6H2O(g)。
5N2(g)+6H2O(g)。
①能說明該反應已達到平衡狀態的標志是____(填字母序號)
a.反應速率5v(NH3)=4v(N2)
b.單位時間里每生成5mol N2,同時生成4mol NH3
c.容器內N2的物質的量分數不再隨時間而發生變化
d.容器內n(NO):n(NH3):n(N2):n(H2O)=6:4:5:6
②某次實驗中測得容器內NO及N2的物質的量隨時間變化如圖所示,圖中v(正)與v(逆)相等的點為_____(選填字母)。

(3)298K時,若已知生成標準狀況下2.24LNH3時放出熱量為4.62kJ。寫出合成氨反應的熱化學方程式____。
(4)一定條件下,在2L密閉容器內,反應2NO2(g)=N2O4(g)△H=-180kJ·mol-1,n(NO2)隨時間變化如下表:
時間/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 0.040 | 0.020 | 0.010 | 0.005 | 0.005 | 0.005 |
用NO2表示0~2s內該反應的平均速度____。在第5s時,NO2的轉化率為____。根據上表可以看出,隨著反應進行,反應速率逐漸減小,其原因是____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】AOH為弱堿,已知:2AOH(aq)+H2SO4(aq)===A2SO4(aq)+2H2O(l) ΔH1=-24.2 kJ·mol-1;H+(aq)+OH-(aq)===H2O(l) ΔH2=-57.3 kJ·mol-1。則AOH在水溶液中電離的ΔH為( )
A. +33.1 kJ·mol-1 B. +45.2 kJ·mol-1 C. -81.5 kJ·mol-1 D. -33.1 kJ·mol-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向體積為2 L的固定密閉容器中通入2mol X氣體,在一定溫度下發生如下反應:2X(g) ![]() Y(g)+3Z(g)ΔH=+92.0kJ· mol-1。經5 min 后反應達到平衡,此時測得容器內的壓強為起始時的1.5倍。
Y(g)+3Z(g)ΔH=+92.0kJ· mol-1。經5 min 后反應達到平衡,此時測得容器內的壓強為起始時的1.5倍。
(1)用Y表示的化學反應速率為_____,X的轉化率為______,平衡時反應吸收的熱量為_________。
(2)在定溫,定容的條件下向平衡體系中再充入1mol X(g)氣體,平衡______(填“正向”“不”“逆向”)移動, X(g)的轉化率______(填“增大”“減小”“不變”),Y(g)的質量分數______(填“增大”“減小”“不變”)。
(3)在相同溫度,相同容積的密閉容器中起始時充入0.8molX(g),0.6molY(g),1.8molZ(g),此時V正______V逆(填“大于”、“小于”或“等于”);平衡時X(g)的百分含量______ (填“大于”、“小于”或“等于”)原平衡。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,下列溶液的離子濃度關系式正確的是
A. pH=5的H2S溶液中,c(H+)= c(HS-)=1×10—5 mol·L—1
B. pH=a的氨水溶液,稀釋10倍后,其pH=b,則a﹤b+1
C. pH=2的H2C2O4溶液與pH=12的NaOH溶液任意比例混合:c(Na+)+ c(H+)= c(OH-)+c( HC2O4-)+ c( C2O42-)
D. pH相同的①CH3COONa②NaHCO3③NaClO三種溶液的c(Na+):③>②>①
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】電鍍廢水沉泥中含Cu、Ni、Ag和Fe等多種元素的有機金屬鹽,采用焙燒一浸出—分離回收的工藝流程可有效分離電鍍廢水沉泥中的金屬,其流程如下:
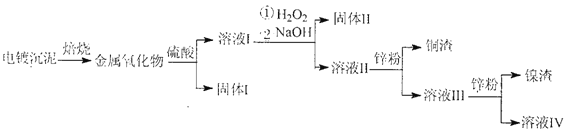
下列敘述錯誤的是
A. 上述流程中硫酸可以用稀鹽酸代替
B. “固體Ⅱ”為Fe(OH)2
C. 溶液III中含有Na+、Ni2+、Zn2+等金屬離子
D. 合理處理電鍍廢沉泥可實現資源的回收與可持續利用
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是一定條件下N2與H2反應過程中能量變化的曲線圖。下列敘述正確的是

A. 該反應的熱化學方程式為:N2+3H2![]() 2NH3 △H=-92kJ·mol-1
2NH3 △H=-92kJ·mol-1
B. a曲線是加入催化劑時的能量變化曲線
C. 加入催化劑,該化學反應的反應熱將發生改變
D. 在相同溫度的條件下,在體積相同I、II兩個容器中分別通入1mol N2和3 mol H2,容器I體積恒定,容器II體積可變保持恒壓,則反應過程中兩容器內的反應速率v(I)<v(II)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期元素X、Y、Z、M的原子序數依次增大,其中X、Y、Z 三種元素中,可形成含二種元素的10電子微粒m、n、p、q,且有反應m+n![]() p
p![]() +q;M的最高價氧化物對應的水化物為最強酸。則下列說法正確是
+q;M的最高價氧化物對應的水化物為最強酸。則下列說法正確是
A. 原子半徑X<M<Z<Y B. 非金屬性X <M<Z<Y
C. X、Y、Z三種元素組成的化合物的水溶液一定呈酸性 D. MZ2可用于自來水的殺菌消毒
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數的值。下列有關敘述正確的是( )
A. 乙烯和丙烯組成的42g混合氣體中碳氫鍵數目為6NA
B. 標準狀兄下,22.4L二氯甲烷的分子數約為NA
C. 常溫常壓下,1mol甲醇完全燃燒生成CO2和H2O,轉移的電子數目為12NA
D. 將1molCH3COONa溶于稀醋酸中使溶液呈中性,溶液中CH3COO-數目小于NA
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com