
【題目】一定溫度下,將1molA(g)和1molB(g)充入2L密閉容器中發生反應,在t1時達到平衡:A(g)+B(g) ![]() xC(g)+D(s),在t2、t3時刻分別改變反應的一個條件,測得容器中C(g)的濃度隨時間變化如圖所示。下列有關說法正確的是
xC(g)+D(s),在t2、t3時刻分別改變反應的一個條件,測得容器中C(g)的濃度隨時間變化如圖所示。下列有關說法正確的是

A. t1~t3間該反應的平衡常數相同,均為0.25 B. t2時刻改變的條件是使用催化劑
C. t3時刻改變的條件是移去少量物質D D. 反應方程式中x=2
 芝麻開花課程新體驗系列答案
芝麻開花課程新體驗系列答案科目:高中化學 來源: 題型:
【題目】已知25 ℃時有關弱酸的電離平衡常數如下表:
弱酸化學式 | CH3COOH | HCN | H2CO3 |
電離平衡常數 | 1.8×10-5 | 4.9×10-10 | K1=4.4×10-7 K2=4.7×10-11 |
下列推斷正確的是
A. 25℃時,同濃度的下列溶液 pH 關系為:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa)
B. 若25℃時某溶液中c(CO32-)=c(HCO3-),則此溶液中 c(H+)=4.7×10-11 mol·L-1
C. 若某溶液中c(CO32-)=c(HCO3-),往該溶液中滴入鹽酸, HCO3-比CO32-更易結合H+
D. 25℃時pH=9的CH3COONa和NaOH溶液,水電離出的c(H+)均為1×10-9mol·L-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為了探究外界條件對H2O2分解速率的影響,有同學利用實驗室提供的儀器和試劑進行了如下實驗,請填寫下列空白:
試劑:5%H2O2 溶液,10%H2O2 溶液,1mol·L-1FeCl3 溶液
儀器: 試管、膠頭滴管、酒精燈
(1)實驗目的:探究溫度對化學反應速率的影響
實驗步驟:分別向A、B 兩支試管中加5 mL 5 % H2O2溶液,將試管A 放入5℃ 水浴中,將試管B 放入40℃水浴中,同時分別向兩試管中加入2~3 滴1mol·L-1FeCl3 溶液,觀察實驗現象。
實驗現象:試管_________(填A 或B)中產生氣泡的速率快,說明_________________。
(2)實驗目的:探究濃度對化學反應速率的影響
實驗步驟:向試管A 中加入5 mL5%H2O2溶液,向試管B 中加入5 mL10%H2O2溶液,觀察實驗現象。
實驗現象:試管A、B 中均有少量氣體緩慢產生。
請你改進實驗方案,使該實驗的實驗現象更為明顯,以支撐“濃度改變會影響化學反應速率”這一理論預測。______________________________________
(3)實驗目的:____________________________。
實驗步驟:分別向試管A 和B 中加入5 mL 5%H2O2溶液后,再向試管B 中加入1mol·L-1FeCl3 溶液,觀察實驗現象。
你認為方案(3) 的設計是否嚴謹?_______(填是或否),說明理由___________________。
(4)下列有關影響化學反應速率的因素的說法錯誤的是__________(填字母)。
a.對于已經達到化學平衡狀態的反應A(g)![]() B(g)+C(g) △H >0,其他條件不變時,升高溫度,正反應速率增大,逆反應速率減小,所以平衡正向移動
B(g)+C(g) △H >0,其他條件不變時,升高溫度,正反應速率增大,逆反應速率減小,所以平衡正向移動
b.其他條件不變時,增大壓強一定能加快化學反應速率
c.其他條件不變時,使用正催化劑,活化分子百分數增大,化學反應速率加快
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定條件下,發生如下反應: A(s)+B(g)![]() C(s)+D(g)+E(g) △H<0,其中相對分子質量M(C)>M(A),起始時通入一定量的A 和B,該反應在恒容的密閉容器中達到平衡后,若僅改變圖中橫坐標x的值。重新達到平衡后。縱坐標yY隨X 變化趨勢合理的是
C(s)+D(g)+E(g) △H<0,其中相對分子質量M(C)>M(A),起始時通入一定量的A 和B,該反應在恒容的密閉容器中達到平衡后,若僅改變圖中橫坐標x的值。重新達到平衡后。縱坐標yY隨X 變化趨勢合理的是

選項 | X | Y |
A | A的質量 | D的體積分數 |
B | B的物質的量 | B的轉化率 |
C | B的濃度 | 平衡常數K |
D | 溫度 | 容器內混合氣體的平均摩爾質量 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】重鉻酸鉀溶液中存在如下平衡:(1)Cr2O72-+H2O![]() 2H++2CrO42-,向2mL0.1mol·L-1酸化的K2Cr2O7溶液中滴入適量(NH4)2Fe(SO4)2溶液,發生反應:Cr2O72-+14H++6Fe2+=2Cr3++6Fe3++7H2O。下列分析正確的是
2H++2CrO42-,向2mL0.1mol·L-1酸化的K2Cr2O7溶液中滴入適量(NH4)2Fe(SO4)2溶液,發生反應:Cr2O72-+14H++6Fe2+=2Cr3++6Fe3++7H2O。下列分析正確的是
A. 向K2Cr2O7溶液加入幾滴濃NaOH溶液,溶液由黃色變成橙黃
B. 氧化性:Cr2O72->Fe3+
C. CrO42-和Fe2+在酸性溶液中能大量共存
D. 向K2Cr2O7溶液中加水稀釋,反應(1)平衡向左移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在燃燒2.24L(標準狀況)CO與O2的混合氣體時,放出11.32kJ的熱量,最后產物的密度為原來氣體密度的1.25倍,則CO的燃燒熱為
A. 283 kJ·mol-1 B. -283 kJ·mol-1 C. -566 kJ·mol-1 D. 566kJ·mol-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在恒壓密閉容器M(如圖Ⅰ)和恒容密閉容器N(如圖Ⅱ)中,分別加入a molA和a molB,起始時兩容器體積均為V L,發生如下反應并達到化學平衡狀態:2A(?)+ B(?)![]() xC(g);ΔH<0,平衡時M中A、B、C的物質的量之比為1∶3∶4.。下列判斷正確的是
xC(g);ΔH<0,平衡時M中A、B、C的物質的量之比為1∶3∶4.。下列判斷正確的是

A. x=4
B. 若N中氣體的密度如圖Ⅲ所示,則A、B可能都是氣態
C. 若A為氣體,B為非氣體,則平衡時M、N中C的物質的量相等
D. 若A、B均為氣體,平衡時M中A的轉化率小于N中A的轉化率
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】活性炭可處理大氣污染物NO.T℃時,在1L密閉容器中加入NO氣體和炭粉,發生反應生成兩種氣體A和B,測得各物質的物質的量如下:
活性炭/mol | NO/mol | A/mol | B/mol | |
起始狀態 | 2.030 | 0.100 | 0 | 0 |
2min時 | 2.000 | 0.040 | 0.030 | 0.030 |
(1)2min內,用NO表示該反應的平均速率v(NO)=molL﹣1min﹣1 .
(2)該反應的化學方程式是 .
(3)一定條件下,在密閉恒容的容器中,能表示上述反應達到化學平衡狀態的是 .
①v(NO):v(A):v(B)=2:1:1
②混合氣體的密度不再改變
③總壓強不再改變
④混合氣體的平均相對分子質量不再改變
(4)碳元素可形成數量眾多,分布極廣的有機化合物,其中甲醇是常見的燃料,甲醇燃料電池的結構示意圖如下,一極通入甲醇,另外一極通入氧氣;電解質溶液是稀硫酸,電池工作時總反應式:2CH3OH+3O2=2CO2+4H2O.
①a處通入的物質是 , 電極反應式為:;
②b處電極反應式為;
③電池工作時H+由極移向極(填正、負極).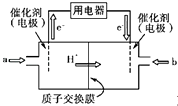
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com