
【題目】C、N和Si能形成多種高硬度材料,如![]() 、
、![]() 、SiC
、SiC

(1)![]() 和
和![]() 中硬度較高的是______,理由是______。
中硬度較高的是______,理由是______。
(2)![]() 和N能形成一種類石墨結構材料,其合成過程如圖1所示。該類石墨結構材料化合物的化學式為______,其合成過程中有三聚氰胺形成,三聚氰胺中N原子的雜化方式有______。
和N能形成一種類石墨結構材料,其合成過程如圖1所示。該類石墨結構材料化合物的化學式為______,其合成過程中有三聚氰胺形成,三聚氰胺中N原子的雜化方式有______。
(3)![]() 和N能形成一種五元環狀有機物咪唑
和N能形成一種五元環狀有機物咪唑![]() 簡寫為
簡寫為![]() ,其結構為
,其結構為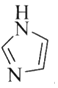
![]() 化合物
化合物![]() 的結構示意圖如圖2:
的結構示意圖如圖2:
①陽離子![]() 和
和![]() 之間除了陰陽離子間的靜電作用力,還存在氫鍵作用寫出該氫鍵的表示式:______。
之間除了陰陽離子間的靜電作用力,還存在氫鍵作用寫出該氫鍵的表示式:______。![]() 例如水中氫鍵的表示式為
例如水中氫鍵的表示式為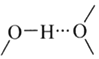
![]()
②多原子分子中各原子若在同一平面,且有相互平行的p軌道,則p電子可在多個原子間運動,形成“離域![]() 鍵”,如
鍵”,如![]() 分子中存在“離域
分子中存在“離域![]() 鍵”
鍵”![]() ,則im分子中存在的“離域
,則im分子中存在的“離域![]() 鍵”是______。
鍵”是______。
(4)![]() 為立方晶系晶體,該晶胞中原子的坐標參數為
為立方晶系晶體,該晶胞中原子的坐標參數為
C:![]() ;
;![]() ;
;![]() 0,
0,![]() ,
,![]() ;
;![]() ;
;![]()
Si:![]() ;
;![]() ;
;![]() ;
;![]()
則![]() 立方晶胞中含有______個Si原子、______個C原子。
立方晶胞中含有______個Si原子、______個C原子。
【答案】![]() 兩者同屬原子晶體
兩者同屬原子晶體![]() 或兩者結構相似
或兩者結構相似![]() ,C的原子半徑小于Si,與
,C的原子半徑小于Si,與![]() 相比,
相比,![]() 的鍵長短、鍵能大
的鍵長短、鍵能大 ![]()
![]() 、
、![]()
![]()
![]() 4 4
4 4
【解析】
![]() 二者均為原子晶體,原子半徑越小,共價鍵鍵長越短,鍵能越大,硬度越大;
二者均為原子晶體,原子半徑越小,共價鍵鍵長越短,鍵能越大,硬度越大;
![]() 環上N原子形成2個
環上N原子形成2個![]() 鍵、含有1對孤電子對,氨基中N原子形成3個
鍵、含有1對孤電子對,氨基中N原子形成3個![]() 鍵、含有1對孤電子對,雜化軌道數目分別為3、4;
鍵、含有1對孤電子對,雜化軌道數目分別為3、4;
![]() 原子與N原子連接的H原子之間形成氫鍵;
原子與N原子連接的H原子之間形成氫鍵;
![]() 五個原子上的6個p電子參與形成離域
五個原子上的6個p電子參與形成離域![]() 鍵;
鍵;
![]() 由C、Si參數可知,C原子處于晶胞的頂點、面心。Si處于晶胞內部,且Si與周圍最近的4個C原子形成正四面體結構,將金剛石晶胞內部的碳原子替換為Si即為
由C、Si參數可知,C原子處于晶胞的頂點、面心。Si處于晶胞內部,且Si與周圍最近的4個C原子形成正四面體結構,將金剛石晶胞內部的碳原子替換為Si即為![]() 晶胞結構。
晶胞結構。
![]() 原子晶體中,成鍵的原子半徑越小,則鍵長越小、鍵能越大,其硬度就越大。所以
原子晶體中,成鍵的原子半徑越小,則鍵長越小、鍵能越大,其硬度就越大。所以![]() 和
和![]() 中硬度較高的是
中硬度較高的是![]() 原因是兩者同屬原子晶體,C的原子半徑小于Si,與
原因是兩者同屬原子晶體,C的原子半徑小于Si,與![]() 相比,
相比,![]() 的鍵長短、鍵能大;
的鍵長短、鍵能大;
![]() 由結構可知,每個碳原子與3個氮原子形成2個單鍵和1個雙鍵,由于氮元素的非金屬性強于碳元素,故碳元素顯
由結構可知,每個碳原子與3個氮原子形成2個單鍵和1個雙鍵,由于氮元素的非金屬性強于碳元素,故碳元素顯![]() 價、氮元素顯
價、氮元素顯![]() 價,由此可判斷出該化合物的化學式為
價,由此可判斷出該化合物的化學式為![]() 三聚氰胺的環中N原子形成2個
三聚氰胺的環中N原子形成2個![]() 鍵,含有1對孤電子對,雜化軌道數目為3,采取
鍵,含有1對孤電子對,雜化軌道數目為3,采取![]() 雜化,氨基中N原子形成3個
雜化,氨基中N原子形成3個![]() 鍵,含有1對孤電子對,雜化軌道數目為4,采取
鍵,含有1對孤電子對,雜化軌道數目為4,采取![]() 雜化;
雜化;
![]() 氫鍵發生在非金屬強的原子和氫原子之間,在該物質中氫鍵可表示為
氫鍵發生在非金屬強的原子和氫原子之間,在該物質中氫鍵可表示為![]() ;
;
![]()
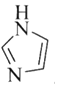 分子中三個C原子采取
分子中三個C原子采取![]() 雜化,每個C原子都有1個p電子,形成3個
雜化,每個C原子都有1個p電子,形成3個![]() 鍵的N原子采取
鍵的N原子采取![]() 雜化,含有1對p電子,形成2個
雜化,含有1對p電子,形成2個![]() 鍵的N原子采取
鍵的N原子采取![]() 雜化,含有1個p電子,五個原子上的6個p電子參與形成離域
雜化,含有1個p電子,五個原子上的6個p電子參與形成離域![]() 鍵,可表示為
鍵,可表示為![]() ;
;
![]() 從該晶胞中原子的坐標參數可知,碳原子位于晶胞的8個頂點和6個面心。每個頂點參與形成8個晶胞,每個面心參與形成2個晶胞,根據均攤法可以計算出一個晶胞中有4個碳原子,而4個硅原子位于晶胞內部,所以SiC立方晶胞中含有4個Si原子、4個C原子。
從該晶胞中原子的坐標參數可知,碳原子位于晶胞的8個頂點和6個面心。每個頂點參與形成8個晶胞,每個面心參與形成2個晶胞,根據均攤法可以計算出一個晶胞中有4個碳原子,而4個硅原子位于晶胞內部,所以SiC立方晶胞中含有4個Si原子、4個C原子。


科目:高中化學 來源: 題型:
【題目】中國古代四大發明之一——黑火藥,它的爆炸反應為2KNO3+3C+S![]() A+N2↑+3CO2↑(已配平)
A+N2↑+3CO2↑(已配平)
(1)除S外,上列元素的電負性從大到小依次為________。
(2)在生成物中,A的晶體類型為________,含極性共價鍵的分子的中心原子軌道雜化類型為________。
(3)已知CN-與N2結構相似,推算HCN分子中σ鍵與π鍵數目之比為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列圖示與對應的敘述相符的是

A. 圖I表示某吸熱反應分別在有、無催化劑的情況下反應過程中的能量變化
B. 圖Ⅱ表示常溫下,0.1000mol·L-1 NaOH溶液滴定20.00mL 0.1000mol·L-1 CH3COOH溶液所得到的滴定曲線
C. 圖Ⅲ表示一定質量的冰醋酸加水稀釋過程中,溶液的導電能力變化曲線,圖中a、b、c三點醋酸的電離程度:a<b<c
D. 圖Ⅳ表示反應4CO(g)+2NO2(g ) ![]() N2(g)+4CO2(g) ΔH <0,在其他條件不變的情況下改變起始物CO的物質的量,平衡時N2的體積分數變化情況,由圖可知NO2的轉化率b>a>c
N2(g)+4CO2(g) ΔH <0,在其他條件不變的情況下改變起始物CO的物質的量,平衡時N2的體積分數變化情況,由圖可知NO2的轉化率b>a>c
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】東晉《華陽國志南中志》卷四種已有關于白銅的記載,云南鎳白銅(銅鎳合金)文明中外,曾主要用于造幣,亦可用于制作仿銀飾品。回答下列問題:
(1)鎳元素基態原子的價電子軌道表示式___,3d能級上的未成對的電子數為___。
(2)硫酸鎳溶于氨水形成[Ni(NH3)6]SO4藍色溶液。
①[Ni(NH3)6]SO4中陰離子的立體構型是___。
②在[Ni(NH3)6]2+中Ni2+與NH3之間形成的化學鍵稱為___,提供孤電子對的成鍵原子是___。
③氨的沸點_______(“高于”或“低于”)膦(PH3),原因是______。
(3)單質銅及鎳都是由__鍵形成的晶體:元素同與鎳的第二電離能分別為:ICu=1959kJ/mol,INi=1753kJ/mol,ICu>INi的原因是___。
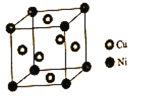
(4)某鎳白銅合金的立方晶胞結構如圖所示。
①晶胞中銅原子與鎳原子的數量比為___。
②若合金的密度為dg/cm3,晶胞參數a=____nm。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2018年3月南京理工教授制出了一種新的全氮陰離子鹽—AgN5,目前已經合成出鈉、錳、鐵、鈷、鎳、鎂等幾種金屬的全氮陰離子鹽。
(1)基態Ni3+的價電子排布式為________;銀與銅位于同一族,銀元素位于元素周期表的________區。
(2)[Mg(H2O)6]2+[(N5)2(H2O)4]2-的晶體結構如圖1所示:
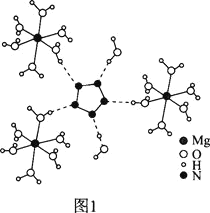
![]() 、O、Mg元素的前3級電離能如下表所示:
、O、Mg元素的前3級電離能如下表所示:
元素 | I1/kJmol-1 | I2/kJmol-1 | I3/kJmol-1 |
X | 737.7 | 1450.7 | 7732.7 |
Y | 1313.9 | 3388.3 | 5300.5 |
Z | 1402.3 | 2856.0 | 4578.1 |
X、Y、Z中為N元素的是________,判斷理由是________。
②從作用力類型看,Mg2+與H2O之間是________、N5-與H2O之間是________。
③N5-為平面正五邊形,N原子的雜化類型是________。科學家預測將來還會制出含N4-、N6-等平面環狀結構離子的鹽,這一類離子中都存在大π鍵,可用符號![]() 表示,其中m代表參與形成大
表示,其中m代表參與形成大![]() 鍵的原子數,n代表參與形成大
鍵的原子數,n代表參與形成大![]() 鍵的電子數
鍵的電子數![]() 如苯分子中的大
如苯分子中的大![]() 鍵可表示為
鍵可表示為![]() ,則N4-中的大
,則N4-中的大![]() 鍵應表示為________。
鍵應表示為________。
(3)AgN5的立方晶胞結構如圖2所示:
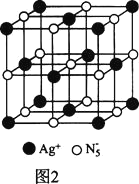
Ag+周圍距離最近的Ag+有________個。若晶體中緊鄰的N5-與Ag+的平均距離為anm,NA表示阿伏加德羅常數的值,則AgN5的密度可表示為________gcm-3用含a、NA的代數式表示![]() 。
。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有六種元素,其中A、B、C、D、E為短周期主要族元素,F為第四周期元素,它們的原子序數依次增大。請根據下列相關信息,回答問題。
A元素形成的物質種類繁多,其形成的一種固體單質工業上常用作切割工具 |
B元素原子的核外p電子數比s電子數少1 |
C元素基態原子p軌道有兩個未成對電子 |
D原子的第一至第四電離能分別是: Ⅰ1=738kJ·mol-1;Ⅰ2=1451kJ·mol-1;Ⅰ3=7733kJ·mol-1;Ⅰ4=10540kJ·mol-1; |
E原子核外所有p軌道全滿或半滿 |
F在周期表的第8縱列 |
(1)某同學根據上述信息,推斷A基態原子的核外最子排布為了![]() ,該同學所畫的電子排布圖違背了___________。
,該同學所畫的電子排布圖違背了___________。
(2)B元素的電負性_____(填“大于”、“小于”或“等于”)C元素的電負性。
(3)C與D形成的化合物所含有的化學鍵類型為_____________。
(4)E基態原子中能量最高的電子,其電子云在空間有__________個方向。
(5)下列關于F原子的價層電子排布圖正確的是___________。
a.![]() b.
b.![]()
c.![]() d.
d.![]()
(6)基態F3+離子核外電子排布式為_____________。過量單質F與B的最高價氧化物的水化物的稀溶液完全反應,生成BC氣體,該反應的離子方程式為____________。
(7)元素銅與鎳的第二電離能分別為:ICu=1959kJ·mol-1,INi=1753kJ·mol-1,ICu>INi原因是__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某課外化學興趣小組欲從鋁土礦中提取少量的Al2O3,查閱資料得知,鋁土礦的主要成分是Al2O3,雜質是Fe2O3、SiO2等。從鋁土礦中提取Al2O3的過程如下:
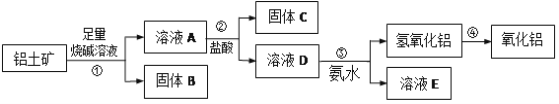
(1)固體B的主要用途為(只寫一種即可)______;
(2)第①步,向鋁土礦中加入足量燒堿溶液,充分反應。發生反應的離子方程式是:______
(3)第③步的實驗操作名稱是______,請簡述洗滌的操作過程______。若往A溶液中通入足量CO2,產生的沉淀為______(填化學式);
(4)工業上制取AlCl3常用Al2O3與炭、Cl2在高溫條件下反應,已知每消耗0.5mol炭單質,轉移1mol電子,則該反應的化學方程式為______
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各表述與示意圖一致的是

A.圖①表示25℃時,用0.1mol/L鹽酸滴定20mL0.1mol/LNaOH溶液,溶液的pH隨加入酸體積的變化得到的滴定曲線
B.圖②表示一定條件下進行的反應2SO2(g)+O2(g)![]() 2SO3(g)△H<O各成分的物質的量變化.t2時刻改變的條件可能是降低溫度或縮小容器體積
2SO3(g)△H<O各成分的物質的量變化.t2時刻改變的條件可能是降低溫度或縮小容器體積
C.圖③表示某明磯溶液中加入Ba(OH)2溶液,沉淀的質量與加入Ba(0H)2溶液體積的關系,在加入20mL溶液時鋁離子恰好沉淀完全
D.圖④表示化學反應H2(g)+Cl2(g)=2HCl(g)的能量變化,則該反應的反應熱△H=+183kJ/mol
查看答案和解析>>
科目:高中化學 來源: 題型:
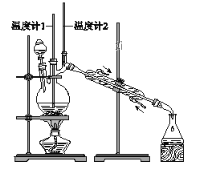
【題目】已知:CH3CH2CH2CH2OH→CH3CH2CH2CHO
利用下圖裝置用正丁醇合成正丁醛。相關數據如下:
物質 | 沸點/℃ | 密度/(g·cm-3) | 水中溶解性 |
正丁醇 | 117.2 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
下列說法中,不正確的是( )
A. 為防止產物進一步氧化,應將酸化的Na2Cr2O7溶液逐滴加入正丁醇中
B. 向獲得的粗正丁醛中加入少量金屬鈉,檢驗其中是否含有正丁醇
C. 反應結束,將餾出物倒入分液漏斗中,分去水層,粗正丁醛從分液漏斗上口倒出
D. 當溫度計1示數為90~95℃,溫度計2示數在76℃左右時,收集產物
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com