
部分氧化的Fe-Cu合金樣品(氧化產物為Fe2O3、CuO)共5.76g,如附圖所示流程處理,下列說法中,正確的是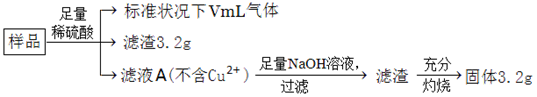
| A.濾液A中陽離子為Fe2+、H+ |
| B.樣品中金屬Fe的質量為2.14g |
| C.樣品中CuO的質量為4.0g |
| D.V=448 |
AD
解析試題分析:A、生成的濾渣3.2g是銅,金屬銅可以和三價鐵反應,所以一定不含有+3價鐵離子,硫酸過量含有氫離子,故A正確;B、固體為三氧化二鐵,其物質的量為3.2g÷160g/mol=0.02mol,鐵元素的量為0.02mol×2=0.04mol,質量為:0.04mol×56g/mol=2.24g,故B錯誤;C、根據B的答案知道鐵元素質量=2.24g,而原來固體才5.76g,所以CuO質量不超過5.76-2.24=3.52g,故C錯誤;D、根據最后溶液中溶質為過量H2SO4和FeSO4,而鐵元素物質的量為0.04mol,說明參加反應硫酸物質的量為0.04mol,含氫離子0.08mol,其中部分氫離子生成氫氣,另外的H+和合金中的氧結合成水了,由于合金中氧物質的量(5.76?3.2?2.24)g÷16g/mol=0.02mol,它結合氫離子0.04mol,所以硫酸中有0.08-0.04=0.04molH+生成氫氣,即生成0.02mol氫氣,標況體積為448ml,故D正確,答案選AD。
考點:考查金屬鐵、銅及其氧化物與稀硫酸反應的有關計算


 培優好卷單元加期末卷系列答案
培優好卷單元加期末卷系列答案 一線名師權威作業本系列答案
一線名師權威作業本系列答案科目:高中化學 來源: 題型:單選題
下列化學用語不能正確解釋相關事實的是
A.堿性氫氧燃料電池的正極反應:H2 - 2e- + 2OH-="==" 2H2O  | B.用電子式表示NaCl的形成過程: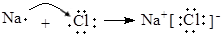 催化劑 |
| C.向含有Hg2+的廢水中加入Na2S可除去Hg2+:Hg2+ + S2- ="==" HgS↓ | D.汽車尾氣系統的催化轉化器可降低NO等的排放:2CO+ 2NO ="==" 2CO2 +N2 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
設NA表示阿伏加德羅常數的值,下列敘述正確的是
| A.常溫常壓下,4.6g NO2或N2O4氣體中所含原子總數均為0.3NA |
| B.標準狀況下,22.4 mL Br2所含的分子數為0.001NA |
| C.標準狀況下,22.4L的Cl2與1molFe充分反應,轉移的電子數為3NA |
| D.100 mL0.1mol?L-1的H2SO3溶液中,H+總數為0.02 NA |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
NA表示阿伏加德羅常數,下列敘述正確的是( )
| A.常溫下,9g H2O中含NA個O–H鍵 |
| B.1 molFe2+與足量稀硝酸反應,轉移3 NA個電子 |
| C.常溫常壓下,22. 4L SO2和O2的混合氣體中含2NA個氧原子 |
| D.0. 1 mol·L–1KAl(SO4)2溶液中含0.2NA個SO42- |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
設NA為阿伏加德羅常數,下列敘述中正確的是
| A.同溫同壓下,原子數均為NA的氫氣和氦氣具有相同的體積 |
| B.室溫下,21.0g乙烯和丁烯的混合氣體中含有的碳原子數目為3NA |
C.常溫常壓下,1mol甲基(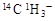 )所含的中子數和電子數分別為8NA、9NA )所含的中子數和電子數分別為8NA、9NA |
| D.在密閉容器中加入28g N2和6g H2,在高溫、高壓、催化劑的條件下充分反應,生成NH3的分子數為2NA |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
在a L Al2(SO4)3和(NH4)2SO4的混合溶液中加入b mol BaCl2,恰好使溶液中的SO42-完全沉淀;如加入足量強堿并加熱可得到c mol NH3,則原溶液中的Al3+物質的量濃度(mol·L-1)為
A.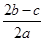 | B.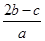 | C. | D.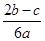 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列敘述正確的是
| A.1 mol·L-1NaCl溶液含有NA個Na+ |
| B.10 mL質量分數為98%的H2SO4用水稀釋至100 mL,H2SO4的質量分數應大于9.8% |
| C.配制240 mL 1 mol·L-1的NaOH溶液需稱NaOH固體的質量為9.6 g |
| D.配制1 mol·L-1的H2SO4溶液時,將量取的濃H2SO4放入容量瓶中加水稀釋 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com