
已知某物質主要成分的化學式為XY2,X原子的結構示意圖為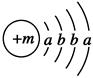 ,X的陽離子與Y的陰離子的電子層結構相同。元素Z、W均為短周期元素,它們原子的最外層電子數均是其電子層數的2倍,Z與Y相鄰且Z、W能形成一種WZ2型分子。
,X的陽離子與Y的陰離子的電子層結構相同。元素Z、W均為短周期元素,它們原子的最外層電子數均是其電子層數的2倍,Z與Y相鄰且Z、W能形成一種WZ2型分子。
(1)m=________,該物質主要成分的化學式為________。
(2)Z、W元素的名稱為________、________。
(3)下列說法正確的是________。
| A.XY2和WZ2都為離子化合物 |
| B.XY2分子中僅含離子鍵,WZ2中僅含極性共價鍵 |
| C.H2Z比HY的穩定性強 |
| D.X的陽離子比Y的陰離子半徑大 |

科目:高中化學 來源: 題型:填空題
原子序數小于36的四種元素X、Y、Z、W,有關它們的信息如下表所示:
| 元素 | 部分結構知識 | 部分性質 |
| X | X原子核外電子排布在三個能級上,且有三個電子能量相同 | X有多種氧化物,如XO、XO2、X2O4等;通常情況下XO2與X2O4共存 |
| Y | Y原子的最外層電子數等于次外層電子數的2倍 | Y是形成化合物種類最多的元素 |
| Z | Z原子的最外層電子數多于4 | Z元素的最高正化合價與最低負化合價代數和等于6 |
| W | W的一種核素質量數為52,中子數為28 | +6價W的化合物有強氧化性,可用于皮革加工、吹氣法檢查司機是否酒駕等 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
科學家發現:具有2、8、20、28、50、82、114、126等數目的質子或中子的原子核具有特別的穩定性,并將這些偶數稱為“幻數”,而具有雙幻數的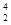 He、
He、 Ni、
Ni、 Sn、Pb等尤為穩定。根據此信息回答下列問題:
Sn、Pb等尤為穩定。根據此信息回答下列問題:
(1)寫出前三種質子數為“幻數”的元素原子的結構示意圖,并標明元素符號__________________。
(2)已知氧有三種同位素 O、
O、 O、
O、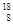 O,根據上述“幻數”規律,氧的同位素中原子核最穩定的是________。
O,根據上述“幻數”規律,氧的同位素中原子核最穩定的是________。
(3)根據現有元素周期律推算,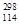 R位于元素周期表的第________周期第________族,核穩定性
R位于元素周期表的第________周期第________族,核穩定性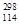 R__________
R__________ R(填“>”、“<”或“=”)。
R(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
下表是元素周期表的一部分。表中所列的字母分別代表某一化學元素。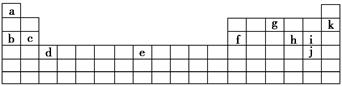
用上表中的字母代號回答下列問題:
(1)屬于鹵族元素的有_________________________________________;
(2)屬于稀有氣體元素的有_____________________________________;
(3)屬于第ⅠA金屬元素的有___________________________________;
(4)寫出c元素在周期表中的位置_______________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
下列曲線分別表示元素的某種性質與核電荷數的關系(Z為核電荷數,Y為元素的有關性質)。
(1)把與下面元素有關性質相符的曲線標號填入相應的空格中: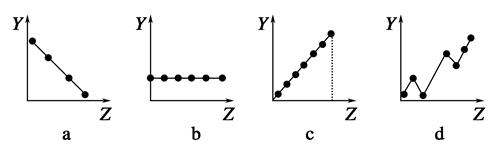
①第ⅡA族元素的價電子數________。
②第三周期元素的最高化合價________。
③F-、Na+、Mg2+、Al3+的離子半徑________。
(2)元素X、Y、Z、M、N均為短周期主族元素,且原子序數依次增大。已知Y原子最外層電子數與核外電子總數之比為3∶4;M元素原子的最外層電子數與電子層數之比為4∶3;N-、Z+、X+的半徑逐漸減小;化合物XN常溫下為氣體。據此回答:
①X為________(名稱),Y為________(元素符號),Z原子結構示意圖為________。
②N的最高價氧化物的水化物的化學式為__________。
③工業上制取單質M的化學方程式為______________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
有H、D、T三種原子,各自可形成雙原子分子H2、D2、T2,請填寫下列各題。
(1)標準狀況下,它們的密度之比為________。
(2)相同物質的量的三種單質中,質子數之比為________。
(3)各1 g三種單質中,它們的質子數之比為________。
(4)同溫同壓下,1 L各單質氣體中所含電子數之比為________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
物質結構的多樣性讓人類使用的材料精彩紛呈。
(1)如圖是原子序數相連的七種短周期元素第一電離能示意圖。其中硼B元素是 (填圖中元素代號)。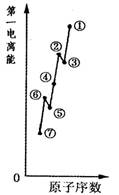
(2)乙二酸俗名草酸,是最簡單的有機二元酸之一,結構簡式為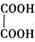 ,草酸鈉晶體中存在 (填圖中元素代號)。
,草酸鈉晶體中存在 (填圖中元素代號)。
A金屬鍵;B非極性鍵;C鍵;D范德華力;E氫鍵;F離子鍵
(3)氧化鋯(ZrO2)材料具有高硬度,高強度,高韌性,極高的耐磨性及耐化學腐蝕性,氧化鋯陶瓷在許多領域獲得廣泛應用。鋯石與鈦同族的第五周期元素,鋯原子的價電子排布式為 。
(4)含氧酸可電離的氫原子來自羥基,碳酸的結構式可表達為 ;若碳酸中的碳氧原子都在同一平面,則碳原子的雜化類型是 。
(5)PtCl4和氨水反應可獲得PtCl4? 4NH3,PtCl4?4NH3 是一種配合物。100mL0.1mol?L-1PtCl4?4NH3 溶液中滴加足量AgNO3溶液可產生2.87g白色沉淀。該配合物溶于水的電離方程式為 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
現有七種短周期主族元素,其原子序數按A、B、C、D、E、F、G的順序遞增。A元素的最高正化合價和最低負化合價的代數和等于0,且A是形成化合物種類最多的元素;C原子能形成分別含10電子、18電子的兩種陰離子,且C與F位于同一主族;D單質投入冷水中反應緩慢,投入沸水中迅速產生氣泡;E的簡單陽離子是同周期元素所形成的簡單離子中半徑最小的。回答下列問題:
(1)B位于周期表第________周期第________族。
(2)A、B、C三種元素能形成等電子體,請寫出其中一組等電子體:________________________________________________________________________。
(3)元素M位于E與F元素之間,且M單質是優良的半導體材料,廣泛用于太陽能電池。M、F、G的氣態氫化物的穩定性由強到弱的順序為______________(用化學式表示)。
(4)若選擇三種試劑設計實驗能證明非金屬性:B>A>M,用化學方程式表示實驗原理:__________________________________________________。
(5)A、M、F、G的最高價氧化物對應水化物的酸性由強到弱的順序為________________________(用化學式表示)。
(6)下列實驗方法能證明D與E的金屬性強弱關系的是________(填字母序號)。
A.比較D和E的單質分別與稀硫酸反應產生氣泡的快慢
B.比較D和E的單質分別與同濃度的氫氧化鈉溶液反應產生氣泡的快慢
C.比較D和E的單質分別與氯氣、氧氣、硫等非金屬單質反應的產物
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
有原子序數依次增大的A、B、C、D、E五種元素,A是短周期中族序數等于周期數的非金屬元素;B元素的原子既不易失去也不易得到電子,其基態原子每種軌道中電子數相同;C元素的價電子構型為nsnnpn+1;D的最外層電子數與電子層數之比為3∶1;E是地殼中含量僅次于鋁的金屬元素,其合金用途最廣,用量最大。
(1)B與D形成的非極性分子中中心原子的孤對電子數是________,中心原子的雜化軌道類型為________。
(2)A分別與B、C、D能形成電子數為10的化合物,它們的沸點由高到低的順序是____________(寫分子式),它們的穩定性由弱到強的順序是_______________________________________________________(寫分子式)。
(3)分子ABC、BA2D的空間構型分別是________、________。
(4)B、C、D三種元素的電負性由大到小的順序是________(用元素符號表示),第一電離能由大到小的順序是________(用元素符號表示)。
(5)C的單質分子中存在________個π鍵、________個σ鍵。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com