
【題目】“熒光粉”所用的高純度氯化鈣中若混有鎂離子,除去的方法是把氯化鈣的水溶液加熱到90﹣95℃,在不斷攪拌的條件下加入適當的沉淀劑,使鎂離子生成沉淀過濾除去.此沉淀劑最好是( )
A.燒堿
B.純堿
C.小蘇打
D.石灰漿
科目:高中化學 來源: 題型:
【題目】下列關于Na2CO3固體和NaHCO3固體性質的有關敘述中正確的是
A.在水中溶解性:Na2CO3>NaHCO3
B.熱穩定性:Na2CO3<NaHCO3
C.與相同濃度的鹽酸反應的速度:Na2CO3>NaHCO3
D.Na2CO3與NaHCO3相互轉化的反應是可逆反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關甲烷的說法中,不正確的是
A. 1mol甲烷中含有4mol C—H共價健
B. CH4、CCl4和CH3Cl都是正四面體結構
C. 光照條件下甲烷能與溴蒸氣發生取代反應
D. 通常情況下,甲烷跟強酸、強堿、強氧化劑不反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鈉與水反應的改進實驗操作如下:取一張濾紙,用酚酞試液浸潤并晾干,裁剪并折疊成信封狀,濾紙內放一小塊(約綠豆粒般大小)金屬鈉,把含鈉的濾紙信封放入水中,裝置如下圖所示。

請回答:
(1)寫出金屬鈉與水反應的離子方程式________________。
(2)實驗過程中取用金屬鈉的操作方法是________________。
(3)有關此實驗的說法正確的是________________。
A.實驗過程中,可能聽到爆鳴聲
B.實驗過程中,看到濾紙信封由白色逐漸變紅色
C.實驗改進的優點之一是由實驗現象能直接得出反應產物
D.實驗過程中,多余的金屬鈉不能放回原試劑瓶中,以免對瓶內試劑產生污染
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】能源是人類生活和社會發展的基礎,研究化學反應中的能量變化,有助于更好地利用化學反應為生產和生活服務。
(1)天然氣和可燃冰(mCH4·nH2O)既是高效潔凈的能源,也是重要的化工原料,
①甲烷分子的空間構型為__________,可燃冰(mCH4·nH2O)屬于________晶體。
②已知25℃、101kPa時,1g甲烷完全燃燒生成液態水放出55.65kJ熱量,則該條件下反應
CH4(g)+2O2(g)=CO2(g)+2H2O(l)的△H=______kJ·mol-1
(2)用甲烷-氧氣堿性(KOH溶液)燃料電池作電源,電解CuCl2溶液。反應裝置如下圖所示:
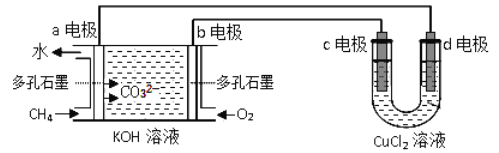
①b電極名稱為___________,d電極的電極反應式為_________。
②假設CuCl2溶液足量,當某電極上析出3.2g金屬Cu時,理論上燃料電池消耗氧氣在標準狀況下的體積是______ mL。
(3)在相同條件下,下面各組熱化學方程式中,△H1<△H2的是________。(填字母)
A組:2H2(g)+O2(g)=2H2O(g) △H1 2H2(g)+O2(g)═2H2O(l) △H2
B組:S(g)+O2(g)=SO2(g) △H1 S(s)+O2(g)=SO2(g) △H2
C組:C(s)+1/2O2(g)=CO(g) △H1 C(s)+O2(g)=CO2(g) △H2
D組:CO(g)+1/2O2(g)=CO2(g) △H1 2CO(g)+O2(g)=2CO2(g) △H2
(4)25℃,10lkPa條件下,14gN2和3gH2應生成NH3的能量變化如下圖所示:

己知:①x=1127;
②25℃101kPa下,N2(g)+3H2(g)![]() 2NH3(g) △H=-92kJ·mol-1。則y=___________。
2NH3(g) △H=-92kJ·mol-1。則y=___________。
(5)金屬材料的腐蝕是人類面臨的嚴重問題,金屬的防腐對節約能源、保護環境起著十分重要的作用。下列三個裝置中,鐵被腐蝕速率由快到慢的順序為_________(填字母)。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列為四個常用的電化學裝置,關于它們的敘述正確的是( )

A. 圖(a)所示電池中,MnO2的作用是催化劑
B. 圖(b)所示電池放電過程中,硫酸濃度不斷增大
C. 圖(c)所示裝置工作過程中,電解質溶液中Cu2+濃度始終不變
D. 圖(d)所示電池中,Ag2O是氧化劑,電池工作過程中還原為Ag
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列物質的名稱或俗名與化學式相對應的
A. 小蘇打——Na2CO3 B. 火堿——Na2O2
C. 磁性氧化鐵——Fe2O3 D. 醋酸——CH3COOH
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有25 ℃時0.1 mol/L的氨水。請回答以下問題:
(1)若向氨水中加入少量硫酸銨固體,此時溶液中氫氧根離子濃度________(填“增大”“減小”或“不變”);
(2)若向氨水中加入稀硫酸,使其恰好中和,寫出反應的離子方程式________________;所得溶液的pH________7(填“>”“<”或“=”),用離子方程式表示其原因______________________。
(3)若向氨水中加入稀硫酸至溶液的pH=7,此時c(NH4+)=a mol·L-1,則c(SO42-)=________;
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某pH=1的ZnCl2和HCl的混合溶液中含有FeCl3雜質,為了除去FeCl3雜質,需將溶液調至pH=4,在調節溶液pH值時應選用的試劑是
A. NaOH B. NH3·H2O C. ZnO D. Fe2O3
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com