
【題目】生產自來水最重要的兩步工序是凈化和消毒,凈化一般使用![]() ,消毒一般使用
,消毒一般使用![]() 。
。
(1)![]() 溶液呈酸性的原因是(用離子方程式表示)____________;
溶液呈酸性的原因是(用離子方程式表示)____________;![]() 具有凈水作用,但會腐蝕鋼鐵設備,除
具有凈水作用,但會腐蝕鋼鐵設備,除![]() 作用外,另一主要原因是(用離子方程式表示):____________。
作用外,另一主要原因是(用離子方程式表示):____________。
(2)氯氣的水溶液稱為氯水,氯水中存在多個平衡,寫出其中兩個含氯元素的平衡方程式:____________、____________。氯水中存在![]() 分子、
分子、![]() 分子和
分子和![]() 分子,不存在
分子,不存在![]() 分子的原因是_______,除水分子外,新制氯水中含量最多的微粒是__________。
分子的原因是_______,除水分子外,新制氯水中含量最多的微粒是__________。
(3)次氯酸有漂白殺菌作用,其作用原理是![]() ,該變化是____________反應(選填“氧化”、“還原”、“氧化還原”);在
,該變化是____________反應(選填“氧化”、“還原”、“氧化還原”);在![]() 溶液中通入少量
溶液中通入少量![]() 氣體,只發生如下反應:
氣體,只發生如下反應:![]() ,由此判斷
,由此判斷![]() 、
、![]() 和
和![]() 的酸性由強到弱的順序是____________。
的酸性由強到弱的順序是____________。
(4)![]() 能用于自來水消毒,還能除去水中的
能用于自來水消毒,還能除去水中的![]() 雜質,產物為
雜質,產物為![]() 和鹽酸。寫出該反應的離子方程式__________________。
和鹽酸。寫出該反應的離子方程式__________________。
【答案】![]()
![]()
![]()
![]()
![]() 是強電解質,在水中完全電離
是強電解質,在水中完全電離 ![]() 還原
還原 ![]()
![]()
【解析】
(1)![]() 是強酸弱堿鹽,在水溶液中易發生水解而使溶液呈酸性,離子方程式為
是強酸弱堿鹽,在水溶液中易發生水解而使溶液呈酸性,離子方程式為![]() 。
。![]() 會腐蝕鋼鐵設備,除
會腐蝕鋼鐵設備,除![]() 作用外,另一主要原因為
作用外,另一主要原因為![]() ;
;
(2)氯水中存在多個平衡,其中兩個含氯元素的平衡方程式為:![]() ,
,![]() 。氯水中不存在
。氯水中不存在![]() 分子的原因是
分子的原因是![]() 是強電解質,在水中完全電離。除水分子外,新制氯水中含量最多的微粒是
是強電解質,在水中完全電離。除水分子外,新制氯水中含量最多的微粒是![]() 。 (3)次氯酸有漂白殺菌作用,其作用原理是
。 (3)次氯酸有漂白殺菌作用,其作用原理是![]() ,在該變化中,只有Cl由+1價降低到-1價,所以該反應是還原反應。在
,在該變化中,只有Cl由+1價降低到-1價,所以該反應是還原反應。在![]() 溶液中通入少量
溶液中通入少量![]() 氣體,只發生如下反應:
氣體,只發生如下反應:![]() 。根據強酸制備弱酸的原理可知
。根據強酸制備弱酸的原理可知![]() 、
、![]() 和
和![]() 的酸性由強到弱的順序是
的酸性由強到弱的順序是![]() ;
;
(4)![]() 能用于自來水消毒,還能除去水中的
能用于自來水消毒,還能除去水中的![]() 雜質,產物為
雜質,產物為![]() 和鹽酸。該反應的離子方程式
和鹽酸。該反應的離子方程式![]() 。
。


科目:高中化學 來源: 題型:
【題目】由甲酸甲酯、葡萄糖、乙醛、丙酸四種物質組成的混合物,已知其中氧元素的質量分數為44%,則氫元素的質量分數為( )
A. 48%B. 8%C. 56%D. 10%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】請按要求完成下列各題。
(1)將2molL-1Al2(SO4)3和0.2molL-1H2SO4溶液等體積混合(設混合溶液體積等于兩溶液體積之和),計算混合液中c(SO42-)=___molL-1.若用容量瓶以質量分數為98%、密度為1.84g/cm3的濃硫酸,配制480mL濃度成0.2molL-1稀硫酸,計算需要量取___mL的濃硫酸。(讀到小數點后一位)
(2)在標準狀況下,由CO和CO2組成的混合氣體6.72L,質量為12g。此混合物中CO和CO2分子數目之比是___,混合氣體的平均摩爾質量是___。
(3)還原鐵粉與高溫水蒸氣反應的化學方程式:___。
(4)除去Mg粉中的Al粉的試劑是___,反應的離子方程式為:___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將鋁浸入![]() 溶液中,取出晾干,置于空氣中,表面會生成毛狀物質(俗稱毛刷),反應為4Al(Hg)+3O2+2xH2O→2(Al2O3xH2O),下列說法正確的是( )
溶液中,取出晾干,置于空氣中,表面會生成毛狀物質(俗稱毛刷),反應為4Al(Hg)+3O2+2xH2O→2(Al2O3xH2O),下列說法正確的是( )
A.![]() 發生氧化反應,
發生氧化反應,![]() 是氧化劑
是氧化劑
B.![]() 既是氧化產物也是還原產物
既是氧化產物也是還原產物
C.該反應屬于置換反應
D.當![]() 鋁參加反應,轉移電子數為
鋁參加反應,轉移電子數為![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
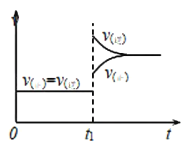
【題目】對于反應![]() ,減小壓強,平衡向______(填“正反應”或“逆反應”)方向移動,平衡混合氣體的平均相對分子質量在平衡移動時______(填“是”或“否”)發生改變,其原因是____________;下圖是反應速率與時間的關系圖,
,減小壓強,平衡向______(填“正反應”或“逆反應”)方向移動,平衡混合氣體的平均相對分子質量在平衡移動時______(填“是”或“否”)發生改變,其原因是____________;下圖是反應速率與時間的關系圖,![]() 時刻引起正、逆反應速率變化的原因可能是____________(寫一條合理原因)。
時刻引起正、逆反應速率變化的原因可能是____________(寫一條合理原因)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將1 mol甲烷與一定量的氯氣混合于一量筒中,倒立于盛有飽和食鹽水的水槽(如圖所示),對于此反應,有關敘述不正確的是( )
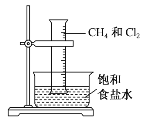
A.該反應的生成物只有四種
B.該反應的條件是光照
C.該反應屬于取代反應
D.該反應現象有量筒內氣體顏色變淺,器壁上有油狀液滴
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】保水劑是一種強吸水樹脂,能在短時間內吸收自身重量幾百倍至上千倍的水分。聚丙烯酸鈉就是一種高吸水性樹脂。下面是丙烯合成聚丙烯酸鈉的化工流程:

(1)上述反應中屬于加成反應的有____________,反應⑧的反應類型為____________;
(2)若(1)的反應條件為通過溴的四氯化碳溶液,請寫出A的結構簡式____________;D中官能團名稱是____________。
(3)請寫出C→D的化學反應方程式__________________。
(4)![]() 是
是![]() 的同系物,式量比
的同系物,式量比![]() 大14,寫出2種符合下列要求的
大14,寫出2種符合下列要求的![]() 的同分異構體:①鏈狀分子;②與新制氫氧化銅在加熱條件下反應生成磚紅色沉淀;③與
的同分異構體:①鏈狀分子;②與新制氫氧化銅在加熱條件下反應生成磚紅色沉淀;③與![]() 溶液混合后滴入酚酞,加熱,溶液顏色變淺。__________、___________
溶液混合后滴入酚酞,加熱,溶液顏色變淺。__________、___________
(5)檢驗反應(4)是否全部轉化的實驗方案__________________。
(6)丙酮(![]() )是一種常用的化工試劑,請設計一條由丙烯制備丙酮的合成路線。(合成路線常用的表示方式為:
)是一種常用的化工試劑,請設計一條由丙烯制備丙酮的合成路線。(合成路線常用的表示方式為:![]() )
)
____________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】香料G的一種合成工藝如圖所示。
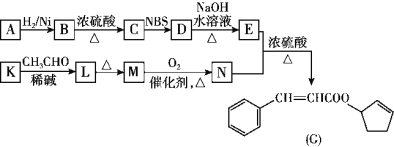
核磁共振氫譜顯示A有兩組峰,其強度之比為1∶1。
已知:(1)CH3CH2CH=CH2![]() CH3CHBrCH=CH2
CH3CHBrCH=CH2
(2)CH3CHO+CH3CHO![]()
![]()
![]() CH3CH=CHCHO+H2O
CH3CH=CHCHO+H2O
請回答下列問題:
(1)A的結構簡式為____________,G中官能團的名稱為____________________。
(2)檢驗M已完全轉化為N的實驗操作是__________________。
(3)有學生建議,將M→N的轉化用KMnO4(H+)代替O2,老師認為不合理,原因是_______________。
(4)寫出K→L的化學方程式:____________________,反應類型為________。
(5)F是比M多一個碳原子的同系物,滿足下列條件的F的同分異構體有________種(不考慮立體異構)。
①能發生銀鏡反應
②能與溴的四氯化碳溶液加成
③苯環上有2個對位取代基
(6)以丙烯和NBS試劑為原料制備甘油(丙三醇),請設計合成路線(其他無機原料任選) _______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】羰基硫(COS)可作為一種糧食熏蒸劑,能防止某些昆蟲、線蟲和真菌的危害。在恒容密閉容器中,將CO和H2S混合加熱并達到下列平衡:CO(g)+H2S(g)![]() COS(g)+H2(g) K=0.1。反應前CO物質的量為10mol,平衡后CO物質的量為8mol。下列說法正確的是( )
COS(g)+H2(g) K=0.1。反應前CO物質的量為10mol,平衡后CO物質的量為8mol。下列說法正確的是( )
A. 平衡后若升高溫度,H2S濃度增加,表明該反應是吸熱反應
B. 當體系的壓強保持不變時,表明該反應達到化學平衡狀態
C. CO的平衡轉化率為80%
D. 反應前H2S物質的量為7mol
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com