
I.甲醇是一種優質燃料,可制作燃料電池。工業上可用下列兩種反應制備甲醇:
已知:CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
2H2(g)+ O2(g)=2H2O(g) ΔH3
則2CO(g)+O2(g)=2CO2(g) 的反應熱ΔH=____ ___(用ΔH1、ΔH2、ΔH3表示)。
II.工業上可利用“甲烷蒸氣轉化法生產氫氣”,反應為:CH4(g)+H2O(g) CO(g)+3H2(g)。
CO(g)+3H2(g)。
已知溫度、壓強和水碳比[n(H2O)/ n(CH4)]對甲烷平衡含量的影響如下圖: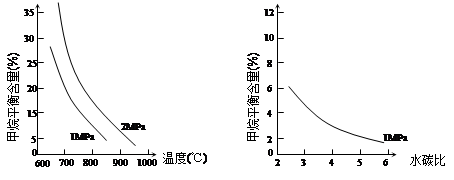
圖1(水碳比為3) 圖2(800℃)
(1)溫度對該反應的反應速率和平衡移動的影響是 。
(2)其他條件不變,請在圖2中畫出壓強為2 MPa時,CH4平衡含量與水碳比之間關系曲線。(只要求畫出大致的變化曲線)
(3)已知:在700℃,1MPa時,1mol CH4與1mol H2O在1L的密閉容器中反應,6分鐘達到平衡,此時CH4的轉化率為80%,求這6分鐘H2的平均反應速率和該溫度下反應的平衡常數是多少?(寫出計算過程,結果保留小數點后一位數字。)
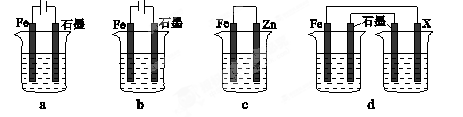
III.某實驗小組設計如圖a所示的電池裝置,正極的電極反應式為____ ____。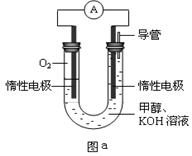
(16分)
I.2ΔH1-2ΔH2+ΔH3(3分)
II.(1)其他條件不變,升高溫度,反應速率加快,平衡向正反應方向移動。(或描述降溫的變化,3分)
(2)如下圖(2分)(形狀1分,標注1分)
(3)計算過程為:(格式2分,速率1分,常數2分,共5分)
CH4(g)+H2O(g)  CO(g)+3H2(g)
CO(g)+3H2(g)
起始濃度(mol/L) 1 1 0 0
變化濃度(mol/L)0.8 0.8 0.8 2.4
平衡濃度(mol/L)0.2 0.2 0.8 2.4
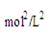
(平衡常數沒寫單位不扣分)
III.O2 + 2H2O + 4e-=4OH-(3分)
解析試題分析:I.先將4個熱化學方程式依次編號為①②③④,再觀察、比較后可得:①×2—②×2+③=④,由蓋斯定律可知,④的焓變=①的焓變×2—②的焓變×2+③的焓變=2ΔH1-2ΔH2+ΔH3;II.(1)先讀圖1,發現在1Mpa或2Mpa、600℃~1000℃時,隨著溫度的升高,甲烷平衡含量均逐漸減小,說明平衡向正反應方向移動;再根據溫度對化學反應速率和化學平衡的影響規律,當其他條件不變時,升高溫度,反應速率加快,平衡向吸熱反應方向或正反應方向移動,則甲烷蒸氣轉化為氫氣的正反應是吸熱反應;(2)畫圖要點:①甲烷蒸氣轉化為氫氣的正反應是氣體體積增大的反應,當溫度和水碳比保持不變時,增大壓強,平衡向氣體體積減小方向或逆反應方向移動,則甲烷平衡含量增大,因此2MPa時甲烷平衡含量與水碳比之間關系曲線一定高于1MPa時甲烷平衡含量與水碳比之間關系曲線;②當溫度和壓強保持不變時,隨著水碳比的增大,甲烷平衡含量逐漸減小;(3)依題意可知該可逆反應中各組分起始、變化、平衡濃度,則:
CH4(g)+H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g)
起始濃度(mol/L) 1 1 0 0
變化濃度(mol/L) 0.8 0.8 0.8 2.4
平衡濃度(mol/L) 0.2 0.2 0.8 2.4
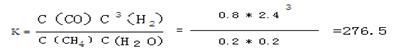
根據平均反應速率的定義式,v(H2)= =
=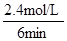 =0.4mol/(L?min)
=0.4mol/(L?min)
根據化學平衡常數的定義式,K= =
=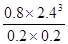 mol2/L2≈276.5 mol2/L2
mol2/L2≈276.5 mol2/L2
III.甲醇燃料電池中正極的主要反應物為氧氣,氧元素由0降為—2價,則1個氧氣分子得到4個電子,在KOH溶液中只能用氫氧根離子使反應物和產物的電荷守恒,則O2+4e-→4OH-;左邊比右邊少4個H、2個O原子,根據氫、氧原子個數守恒可知反應物中還有2H2O,則正極反應式為O2 +4e-+2H2O =4OH-。
考點:考查化學反應原理,涉及根據蓋斯定律求焓變、根據化學平衡圖像得出溫度對反應速率和平衡移動的影響規律、根據壓強對化學平衡的影響規律畫出圖像、根據各組分(起始、變化、平衡)濃度模型法計算平均反應速率和平衡常數、堿性甲醇-空氣燃料電池的正極反應式等。


科目:高中化學 來源: 題型:填空題
重晶石(BaSO4)是重要的化工原料,制備氫氧化鋇晶體[Ba(OH)2·8H2O]的流程如下:
(1)寫出煅燒時發生反應的熱化學方程式:____________________________。
(2)寫出氫氧化鋇晶體與氯化銨晶體混合反應的化學方程式:_____________________。
(3)為檢測煅燒時產生的CO,可將煅燒產生的氣體通入PbCl2溶液中,出現黑色沉淀和產生一種無色無味能使澄清石灰水變渾濁的氣體,試寫出該反應的化學方程式:_____。
(4)向BaSO4沉淀中加入飽和Na2CO3溶液,充分攪拌,棄去上層清液,如此處理多次,可使BaSO4全部轉化為BaCO3。發生的反應可表示為:
BaSO4(s)+CO32-(aq) BaCO3(s)+SO42-(aq)
BaCO3(s)+SO42-(aq)
現有0.20 mol BaSO4,加入1.0L 2.0mol?L-1飽和Na2CO3溶液處理,假設c(SO42-)起始≈0
平衡時,K=4.0x10-2,求反應達到平衡時發生轉化的BaSO4的物質的量。(寫出計算過程結果保留2位有效數字)
(5)試從平衡的角度解釋BaSO4可轉化為BaCO3的原因:________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:問答題
(14分)
以鋅錳廢電池中的碳包(含碳粉、Fe、Cu、Ag和MnO2等物質 )為原料回收MnO2的工藝流程如下:
I. 將碳包中物質烘干,用足量稀HNO3溶解金屬單質,過濾,得濾渣a;
II. 將濾渣a在空氣中灼燒除去碳粉,得到粗MnO2;
III.向粗MnO2中加入酸性H2O2溶液,MnO2溶解生成Mn2+,有氣體生成;
IV. 向III所得溶液(pH約為6)中緩慢滴加0.50 mol?L-1 Na2CO3溶液,過濾,得濾渣b,其主要成分為MnCO3;
V. 濾渣b經洗滌、干燥、灼燒,制得較純的MnO2。
(1)Ι中Ag與足量稀HNO3反應生成NO的化學方程式為 。
(2)已知II的灼燒過程中同時發生反應:
MnO2(s) + C(s) ="==" MnO(s) + CO (g) △H = +24.4kJ ? mol –1 ①
MnO2(s) + CO(g) ="==" MnO(s) + CO2(g) △H = -148.1 kJ ? mol –1 ②
寫出MnO2和C反應生成MnO和CO2的熱化學方程式: 。
(3)H2O2分子中含有的化學鍵類型為 、 。
(4)III中MnO2溶解的離子方程式為 ,溶解一定量的MnO2,H2O2的實際消耗量比理論值高,用化學方程式解釋原因: 。
(5)IV中,若改為“向0.50 mol?L-1 Na2CO3溶液中緩慢滴加III所得溶液”,濾渣b中會混有較多Mn(OH)2沉淀,解釋其原因: 。
(6)V中MnCO3在空氣中灼燒的化學方程式為 。
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
I.工業上可用CO生產燃料甲醇。一定條件下發生反應:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)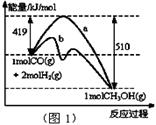
(1)“圖1”表示反應中能量的變化,曲線 (填“a或b”)表示使用了催化劑;該反應的熱化學方程式為 。
(2)若容器容積不變,下列措施可增大CO平衡轉化率的是_____。
| A.升高溫度 |
| B.將CH3OH(g)從體系中分離 |
| C.充入He,使體系總壓強增大 |
| D.再充入1 mol CO和2 mol H2 |
 BaCO3(s)+SO42-(aq)。
BaCO3(s)+SO42-(aq)。查看答案和解析>>
科目:高中化學 來源: 題型:計算題
隨著大氣污染的日趨嚴重,“節能減排”,減少全球溫室氣體排放,研究NOx、SO2、CO等大氣污染氣體的處理具有重要意義。
(1)下圖是在101kPa,298k條件下1mol NO2和1mol CO反應生成1mol CO2和1mol NO過程中能量變化示意圖。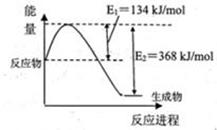
已知:① N2(g)+O2(g)=2NO(g) △H=+179.5kJ/mol
② 2NO(g)+O2(g)=2NO2(g) △H=-112.3kJ/mol
則在298k時,反應:2NO(g)+2CO(g) N2(g)+2CO2(g)的△H= 。
N2(g)+2CO2(g)的△H= 。
(2)將0.20mol NO2和0.10molCO充入一個容積恒定為1L的密閉容器中發生反應,在不同條件下,反應過程中部分物質的濃度變化狀況如圖所示。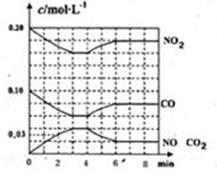
①下列說法正確的是 。(填序號)
a.容器內的壓強不發生變化說明該反應達到平衡
b.當向容器中加再充入0.20mol NO時,平衡向正反應方向移動,K值增大
c.升高溫度后,K值減小,NO2的轉化率減小
d.向該容器內充入He氣,反應物的體積減小,濃度增大,所以反應反應速率增大
②計算產物NO在0~2min時平均反應速率v(NO)= mol·L-1·min-1;
③第4min時改變的反應條件為 (填“升溫”、“降溫”);
④計算反應在第6min時的平衡常數K= 。若保持溫度不變,此時再向容器中充入CO、NO各0.060mol,平衡將 移動(填“正向”、“逆向”或“不”)。
(3)有學者想以如圖所示裝置用原電池原理將SO2轉化為重要的化工原料。其負極的反應式為 ,當有0.25molSO2被吸收,則通過質子(H+)交換膜的H+的物質的量為 。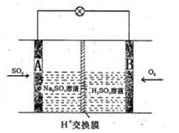
(4)CO2在自然界循環時可與CaCO3反應,CaCO3是一種難溶物質,其KSP=2.8×10-9mol2/L2。現將2×10-4mol/L的Na2CO3溶液與一定濃度的CaC12溶液等體積混合生成沉淀,計算應加入CaC12溶液的最小濃度為 。
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
氨是最重要的化工產品之一。
(1)合成氨用的氫氣可以甲烷為原料制得。有關化學反應的能量變化如下圖所示。
反應①②③為_________反應(填“吸熱”或“放熱”)。CH4(g)與H2O(g)反應生成CO(g)和H2(g)的熱化學方程式為__________________。
① ② ③
(2)用氨氣制取尿素[CO(NH2)2]的反應為:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g)。
CO(NH2)2(l)+H2O(g)。
①某溫度下,向容積為10L的密閉容器中通入2mol NH3和1molCO2,反應達到平衡時CO2的轉化率為50%。該反應的化學平衡常數表達式為K=___________。該溫度下平衡常數K的計算結果為____________。
②為進一步提高CO2的平衡轉化率,下列措施中能達到目的的是_____________
| A.提高NH3的濃度 | B.增大壓強 |
| C.及時轉移生成的尿素 | D.使用更高效的催化劑 |
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
氫是一種理想的綠色清潔能源,氫氣的制取與儲存是氫能源利用領域的研究熱點。利用FeO/Fe3O4循環制氫,已知:
H2O(g)+3FeO(s) Fe3O4(s)+4H2(g) △H=akJ/mol (I)
Fe3O4(s)+4H2(g) △H=akJ/mol (I)
2Fe3O4(s) 6FeO(s)+O2(g) △H=bkJ/mol (II)
6FeO(s)+O2(g) △H=bkJ/mol (II)
下列坐標圖分別表示FeO的轉化率(圖-1 )和一定溫度時,H2出生成速率[細顆粒(直徑0.25 mm),粗顆粒(直徑3 mm)](圖-2)。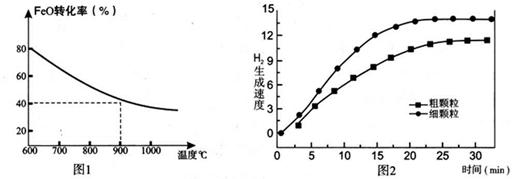
(1)反應:2H2O(g)=2H2(g)+O2(g) △H= (用含a、b代數式表示);
(2)上述反應b>0,要使該制氫方案有實際意義,從能源利用及成本的角度考慮,實現反應II可采用的方案是: ;
(3)900°C時,在兩個體積均為2.0L密閉容器中分別投人0.60molFeO和0.20mol H2O(g)甲容器用細顆粒FeO、乙容器用粗顆粒FeO。
①用細顆粒FeO和粗顆粒FeO時,H2生成速率不同的原因是: ;
②細顆粒FeO時H2O(g)的轉化率比用粗顆粒FeO時H2O(g)的轉化率 (填“大”或“小”或“相等”);
③求此溫度下該反應的平衡常數K(寫出計箅過程,保留兩位有效數字)。
(4)在下列坐標圖3中畫出在1000°C、用細顆粒FeO時,H2O(g)轉化率隨時間變化示意圖(進行相應的標注)。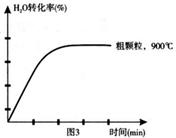
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
高爐煉鐵是冶煉鐵的主要方法,發生的主要反應為:
Fe2O3(s)+3CO(g)  2Fe(s)+3CO2(g) ΔH =" a" kJ mol-1
2Fe(s)+3CO2(g) ΔH =" a" kJ mol-1
(1)已知:
①Fe2O3(s)+3C(石墨) = 2Fe(s)+3CO(g) ΔH1 =" +" 489.0 kJ mol-1
②C(石墨)+CO2(g) = 2CO(g) ΔH2 =" +" 172.5 kJ mol-1
則a = kJ mol-1。
(2)冶煉鐵反應的平衡常數表達式K = ,溫度升高后,K值 (填“增大”、“不變”或“減小”)。
(3)在T℃時,該反應的平衡常數K=64,在2L恒容密閉容器甲和乙中,分別按下表所示加入物質,反應經過一段時間后達到平衡。
| | Fe2O3 | CO | Fe | CO2 |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
在一定溫度下,體積固定的密閉容器中,當下列物理量:①混合氣體的壓強 ② 氣體的總物質的量 ③混合氣體的密度 ④ B的物質的量濃度不再變化時,能表明可逆反應 A(s)+2B(g)  C(g)+D(g) 已達平衡的是 ( )
C(g)+D(g) 已達平衡的是 ( )
| A.①② | B.③④ | C.①④ | D.只有④ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com