
【題目】在恒溫恒容的容器中進行反應 2SO3(g)![]() 2SO2(g)+O2(g),若反應物濃度由1 mol/L降到0.8 mol/L需10s,那么由0.8 mol/L降到0.4 mol/L,需反應的時間為
2SO2(g)+O2(g),若反應物濃度由1 mol/L降到0.8 mol/L需10s,那么由0.8 mol/L降到0.4 mol/L,需反應的時間為
A. 等于10sB. 小于10sC. 等于20sD. 大于20s
 第1卷單元月考期中期末系列答案
第1卷單元月考期中期末系列答案科目:高中化學 來源: 題型:
【題目】一定溫度下,在恒容密閉容器中發生反應NO2(g)+SO2(g)![]() SO3(g)+NO(g)。下列能說明反應達到平衡狀態的是
SO3(g)+NO(g)。下列能說明反應達到平衡狀態的是
A. 體系的壓強保持不變
B. 混合氣體的密度保持不變
C. 混合氣體的顏色保持不變
D. 每消耗1molSO3的同時生成1molNO2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】查閱資料知:Br2的沸點為58.8 ℃,密度為3.119 g·cm-3,微溶于水,有毒。
Ⅰ.(1)常溫下,單質溴通常呈________態,保存時通常在盛溴的試劑瓶中加入少量________。
Ⅱ.工業生產中,海水提取溴常用熱空氣吹出法。其生產流程如下:

某化學實驗小組模擬該法設計了如下實驗裝置(夾持裝置略去)從濃縮的海水中提取液溴。實驗步驟如下:
①關閉活塞b、d,打開活塞a、c,向A中緩慢通入Cl2至反應結束;
②關閉a、c,打開b、d,向A中鼓入足量熱空氣;
③關閉b,打開a,再通過A向B中通入足量的Cl2;
④將B中所得液體進行蒸餾,收集液溴。

(2)當觀察到A中液面上方出現________(實驗現象)時即可判斷步驟①中反應已經結束。
(3)X試劑可以是________(填字母,下同),尾氣處理選用________。
a.H2O b.飽和食鹽水 c.氫氧化鈉溶液 d.飽和Na2SO3溶液
B中X試劑發生反應的離子方程式為________________________________。
(4)蒸餾時應該選擇______(填序號),操作中應控制的關鍵實驗條件為____________。

Ⅲ.該實驗小組利用制得的單質溴研究H2與Br2生成HBr的反應,實驗裝置如下:

(5)E裝置可用來檢驗反應產物HBr,則D裝置的作用是_______。若要檢驗E中收集的HBr,圖示裝置檢驗HBr還不夠完善,請結合原有實驗裝置予以改進:__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】SO2是硫酸工業尾氣的主要成分。以硫酸工業的尾氣聯合制備硫酸鉀和硫酸錳晶體(MnSO4·H2O)的工藝流程如下:

(1)反應Ⅰ的總化學方程式為_______________________________。
(2)反應Ⅱ需控制溫度在60~70 ℃,其原因是_______________________。實驗室控制溫度在60~70 ℃的加熱方法是________________。
(3)上述生產工藝中可循環使用的物質是________________。
(4)檢驗硫酸鉀樣品中是否含有氯化物雜質的實驗操作是_______________________。
(5)已知軟錳礦漿的主要成分是MnO2,則反應Ⅳ中氧化劑與還原劑的物質的量之比為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子在強堿性溶液中能大量共存的是
A.Mg2+、Na+、NO3-、SO42-B.Na+、K+、ClO-、I-
C.Na+、K+、HCO3-、SO42-D.Ba2+、Na+、Cl-、NO3-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】芳香族化合物 A(C9H12O)常用于藥物及香料的合成,A 有如下轉化關系:
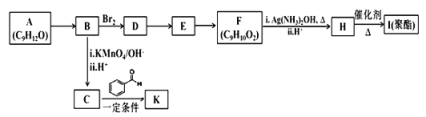
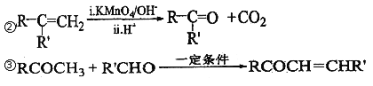
已知以下信息:①A 是芳香族化合物且分子側鏈上有處于兩種不同環境下的氫原子;
回答下列問題:
(1)B 生成 D 的反應類型為___________,由 D 生成 E 的反應所需的試劑及反應條件為_______。
(2)A 中含有的官能團名稱為________________。
(3)K 的結構簡式為________________________。
(4)由 F 生成 H 的反應方程式為________________________。
(5)F 有多種同分異構體,符合下列條件的同分異構體有__________種。
①屬于芳香族化合物 ②能發生水解反應和銀鏡反應
(6)糠叉丙酮(![]() )是一種重要的醫藥中間體,請參考上述合成路線,設計一條由叔丁醇[(CH3)3COH]和糠醛(
)是一種重要的醫藥中間體,請參考上述合成路線,設計一條由叔丁醇[(CH3)3COH]和糠醛(![]() )為原料制備糠叉丙酮的合成路線(無機試劑任用,用結構簡式表示有機物),用箭頭表示轉化關系,箭頭上注明試劑和反應條件)。____________________________
)為原料制備糠叉丙酮的合成路線(無機試劑任用,用結構簡式表示有機物),用箭頭表示轉化關系,箭頭上注明試劑和反應條件)。____________________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某工業含銅廢料含有 Cu、CuO、CuS、CuSO4 等成分,利用該含銅廢料可生產硝酸銅晶體[Cu(NO3)2·3H2O],生產的工藝流程如圖所示,請回答下列問題:
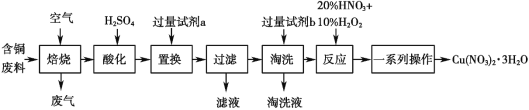
(1)“焙燒”過程中除生成 SO2 的反應外,另外一個反應的化學方程式是______。
(2)“酸化”過程為加快反應速率,可采用的措施有______(寫出一條即可)。
(3)若試劑 a 為 Zn,則“置換”的離子方程式為_____。
(4)“淘洗”的作用是_________________。
(5)“反應”一步中使用 20% HNO3 和 10% H2O2,整個過程無紅棕色氣體產生,則發生反應的離子方程式為_______________________________________;若該步驟只使用 20% HNO3,隨著反應的進行,溫度升高,出現大量紅棕色氣體,則還原劑與氧化劑的物質的量之比為_______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知反應:2NO(g)+Br2(g)![]() 2NOBr(g) △H=-a kJ·mol-1 (a>0),其反應機理如下
2NOBr(g) △H=-a kJ·mol-1 (a>0),其反應機理如下
①NO(g)+Br2(g)![]() NOBr2(g) 快 ②NO(g)+NOBr2(g)
NOBr2(g) 快 ②NO(g)+NOBr2(g)![]() 2NOBr(g) 慢
2NOBr(g) 慢
下列有關該反應的說法正確的是( )
A. 該反應的速率主要取決于①的快慢
B. NOBr2是該反應的催化劑
C. 正反應的活化能比逆反應的活化能小a kJ·mol-1
D. 增大Br2(g)濃度能增大活化分子百分數, 加快反應速率
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com