
【題目】如圖所示,室溫下分別向密閉容器內可移動活塞的兩邊充入空氣(已知空氣體積占整個容器容積的 ![]() )、H2 和O2 的混合氣體,若將H2、O2 的混合氣體點燃引爆.活塞先左彈,恢復室溫后,活塞右滑停留于容器的中央.則原來H2、O2 的物質的量之比可能為:①4:5 ②2:5 ③3:8 ④7:2( )
)、H2 和O2 的混合氣體,若將H2、O2 的混合氣體點燃引爆.活塞先左彈,恢復室溫后,活塞右滑停留于容器的中央.則原來H2、O2 的物質的量之比可能為:①4:5 ②2:5 ③3:8 ④7:2( ) 
A.①②
B.①④
C.②③
D.③④
【答案】B
【解析】解:令空氣的物質的量為1mol,反應前,左右兩室的體積之比為1:3,反應前右室的物質的量為3mol,反應后,活塞處于中央,兩室體積相等,則兩室中氣體的物質的量相等,反應后右室氣體物質的量為1mol,發生反應2H2+O2 ![]() 2H2O,
2H2O,
設H2、O2的物質的量分別為xmol、ymol,
若氫氣過量,則: ![]() ,解得x:y=7:2,
,解得x:y=7:2,
若氧氣過量,則: ![]() ,解得x:y=4:5,
,解得x:y=4:5,
故選B.
反應前,左右兩室的體積之比為1:3,則左右兩室中氣體物質的量之比為1:3,反應后,活塞處于中央,兩室體積相等,則兩室中氣體的物質的量相等,令空氣的物質的量為1mol,設H2、O2的物質的量分別為xmol、ymol,討論氫氣或氧氣過量計算解答.


 名師指導期末沖刺卷系列答案
名師指導期末沖刺卷系列答案科目:高中化學 來源: 題型:
【題目】如圖所示,ΔH1=-393.5 kJ·mol-1,ΔH2=-395.4 kJ·mol-1,下列說法或表示式正確的是( )
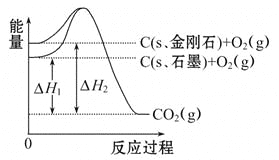
A. C(s、石墨)=C(s、金剛石)ΔH=+1.9 kJ·mol-1
B. 石墨和金剛石的轉化是物理變化
C. 金剛石的穩定性強于石墨
D. 1 mol石墨的能量比1 mol金剛石的總能量大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某實驗興趣小組用如下兩種方法制取氮氣。

已知:活性炭可用于吸附水中的絮狀沉淀。
(1)方法一所發生反應的化學方程式為_________________。
(2)檢驗方法一反應后所得溶液中是否含有NH4+的實驗方法是_________________。
(3)方法二被冰水冷卻的U 型管中所得物質是_________________,用冰水冷卻的目的是_________________。
(4)方法一與方法二相比所具有的優點是_________________。
(5)方法一和方法二中均需用到NH4Cl,NH4Cl的溶解度隨溫度變化的曲線如右圖所示,工業NH4Cl固體中含有少量的FeCl2,可通過如下實驗來提純:將工業NH4Cl固體溶于水,_________,調節溶液的pH為4~5,向溶液中加入活性炭,將溶液加熱濃縮,________獲得純凈的NH4Cl固體。(實驗中可供選擇的試劑有:雙氧水、KMnO4溶液)

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關說法不正確的是
A.其他條件一定時,平衡常數發生變化,化學平衡必定發生移動
B.某特定反應的平衡常數僅是溫度的函數
C.通常情況下,一個放熱且熵增的反應也有可能非自發進行
D.需要加熱或點燃才能進行的反應不一定是非自發反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以軟錳礦粉(主要含MnO2,還含有少量的Fe2O3、Al2O3等雜質)為原料制取高純MnO2的流程如下:

(1)酸浸時所發生主要反應的離子方程式為_____________。
(2)酸浸時加入一定體積的硫酸,硫酸濃度不能過小或過大。當硫酸濃度偏小時,酸浸時會有紅褐色渣出現,原因是_______。硫酸濃度不能過大的原因是_____________。
(3)過濾Ⅱ所得濾渣為MnCO3,濾液中溶質的主要成分是_____。
(4)焙燒MnCO3的裝置如下圖所示:

①焙燒時所發生反應的化學方程式為__________。
②焙燒一定時間后需轉動石英管,目的是_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上以鋰輝石為原料生產碳酸鋰的部分工業流程如下:

已知:
①鋰輝石的主要成分為Li2O·Al2O3·4SiO2,其中含少量Ca、Mg元素。
②Li2O·Al2O3·4SiO2 + H2SO4(濃) ![]() Li2SO4 + Al2O3·4SiO2·H2O
Li2SO4 + Al2O3·4SiO2·H2O
③某些物質的溶解度(s)如下表所示。
T/℃ | 20 | 40 | 60 | 80 |
s(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
s(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
(1)從濾渣Ⅰ中分離出Al2O3的流程如下圖所示。請寫出生成沉淀的離子方程式______。
![]()
(2)已知濾渣2的主要成分有Mg(OH)2和CaCO3。向濾液1中加入石灰乳的作用是(運用化學平衡原理簡述)________________________________________________。
(3)最后一個步驟中,用“熱水洗滌”的原因是______________________________。
(4)工業上,將Li2CO3粗品制備成高純Li2CO3的部分工藝如下:
a.將Li2CO3溶于鹽酸作電解槽的陽極液,LiOH溶液做陰極液,兩者用離子選擇透過膜隔開,用惰性電極電解。
b.電解后向LiOH溶液中加入少量NH4HCO3溶液并共熱,過濾、烘干得高純Li2CO3。
①a中,陽極的電極反應式是_________________________
②電解后,LiOH溶液濃度增大的原因_________________,b中生成Li2CO3反應的化學方程式是___________________________________________。
(5)磷酸亞鐵鋰電池總反應為:FePO4+Li![]() LiFePO4,電池中的固體電解質可傳導Li+,試寫出該電池放電時的正極反應:__________________。
LiFePO4,電池中的固體電解質可傳導Li+,試寫出該電池放電時的正極反應:__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】與自然界中的許多變化一樣,化學反應具有方向性。下列有關敘述中正確的是
A.原電池反應一定是自發進行的氧化還原反應,且△H<0
B.ΔH<0,ΔS<0的反應肯定能自發進行
C.體系能量增大和混亂度增大都有促使反應自發進行的傾向
D.CaCO3(s) =CaO(s)+CO2(g)的ΔH>0,ΔS<0,該反應在較高溫度下能自發進行
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用NA表示阿伏伽德羅常數的值,下列敘述正確的是( )
A. 7.1g氯氣與足量NaOH溶液反應轉移的電子數為0.2NA
B. 1mol C10H22分子中共價鍵總數為32NA
C. 合成氨反應達到平衡時,當1NA N≡N形成的同時,就有6NA N-H鍵形成
D. 1L濃度為1mol/L的碳酸鈉溶液中含有3NA個離子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列由乙烯推測丙烯的結構或性質不正確的是( )
A. 分子中所有原子都在同一平面上 B. 乙烯的沸點比丙烯低
C. 能與H2O、HCl發生加成反應 D. 能使酸性高錳酸鉀溶液褪色
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com