
【題目】化合物X由兩種元素組成,為探究其組成和性質,設計并完成如下實驗:
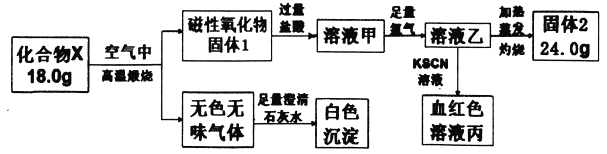
請回答:
(1)X的化學式是________。
(2)溶液甲與足量氯氣反應的離子方程式為____________。
(3)加熱條件下氨氣被固體2氧化成一種氣體單質,寫出該反應的化學方程式_________。
【答案】 Fe3C 2Fe2++ Cl2= 2Fe3++ 2Cl- 2NH3+Fe2O3![]() N2+3H2O+2Fe
N2+3H2O+2Fe
【解析】本題考查實驗方案設計與評價,(1)磁性氧化物是Fe3O4,說明X中含有Fe元素,根據流程圖,固體2為Fe2O3,根據元素和原子守恒,化合物X中Fe的物質的量為24×2/160mol==0.3mol,無色無味氣體能使澄清石灰水變渾濁,因此此氣體為CO2,說明化合物中X中含有C,化合物X中C的質量為(18.0-0.3×56)g=1.2g,C的物質的量為1.2/12mol=0.1mol,即X的化學式為Fe3C;(2)磁性氧化物Fe3O4與鹽酸反應Fe3O4+8HCl=2FeCl3+FeCl2+4H2O,根據流程圖,溶液甲中含有Fe3+和Fe2+,加入氯氣,發生的離子反應方程式為2Fe2++Cl2=2Fe3++2Cl-;(3)NH3被Fe2O3氧化成一種氣體單質,即N轉化成N2,鐵元素被還原成鐵單質,即化學反應方程式為:2NH3+Fe2O3![]() N2+3H2O+2Fe。
N2+3H2O+2Fe。


科目:高中化學 來源: 題型:
【題目】下列說法中正確的是()
A. 能電離出離子的化合物都是離子化合物
B. 熔融狀態下能導電的化合物一定是離子化合物
C. 不同元素組成的多原子分子里的化學鍵一定是極性鍵
D. 非金屬元素構成的單質中一定存在共價鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】標準狀況下,有①6.72LCH4,②3.01×1023個HCl,③13.6gH2S ,④0.2molNH3,則下列四種氣體的關系表示正確的是()
A. 體積:④<①<②<③ B. 密度:①<③<④<②
C. 質量:④<①<③<② D. 氫原子數:②<③<④<①
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知反應4CO+2NO2![]() N2+4CO2在不同條件下的化學反應速率如下,其中表示反應速率最快的是( )
N2+4CO2在不同條件下的化學反應速率如下,其中表示反應速率最快的是( )
A. υ(CO)=1.5 mol·L-1·min-1 B. υ(NO2)=0.7 mol·L-1·min-1
C. υ(N2)=0.4 mol·L-1·min-1 D. υ(CO2)=1.1 mol·L-1·min-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法不正確的是( )
A.毛發和蠶絲的主要成分都是蛋白質
B.天然氣和沼氣的主要成分都是甲烷
C.油脂氫化、氨基酸形成多肽、蛋白質水解都屬于取代反應
D.乙烯、苯乙烯均可發生加聚反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某硫酸廠周圍的空氣含有較多二氧化硫,某化學興趣小組設計了以下裝置和方法測定空氣(內含N2、O2、SO2、CO2等)中SO2含量。
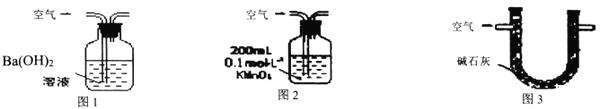
甲.用圖1所示裝置,通入V升空氣,測定生成沉淀的質量
乙.用圖2所示裝置,當KMnO4溶液剛好褪色時,測定通入空氣的體積V
丙.用圖3所示裝置,通入V升空氣,測定U型管增加的質量
(1)你認為可行的操作是________。(填“甲、乙、丙”)
(2)某環保部門為了測定空氣中SO2含量,做了如下實驗:取標準狀況下的空氣VL,緩慢通過足量溴水,在所得的溶液中加入過量的氯化鋇溶液后,過濾,將沉淀洗滌、干燥,稱得其質量為mg。
①若通入氣體的速率過快,則測定的SO2的體積分數_______。(選填“偏高”、“偏低”或“不受影響”)。
②如何判斷氯化鋇溶液已經加過量_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】寫出下列電解質在水溶液中的電離方程式
NaHCO3__________________________
HCl____________________________
CH3COOH_________________________
Fe(OH)3_______________________.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某有機物的結構簡式為 HO-CH2CH=CHCH2-COOH ,該有機物不可能發生的化學反應是 ( )
A. 水解B. 酯化C. 加成D. 氧化
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com