
【題目】下圖是幾種有機物的轉換關系,請按要求填空:

已知:A是來自石油的重要有機化工原料,對水果有催熟作用;75%的B可用于醫用消毒;E是 具有果香味的有機物,結構簡式為C4H8O2;F是一種高聚物,可制成多種包裝材料。
(1)G的名稱是_____________; F的鏈節是_____
(2)反應類型:①__________; ③_____
(3)書寫反應方程式: ②_____
(4)下列關于 A 和 F 的敘述正確的是_____
A.A 常溫下是氣體,為純凈物;F 常溫下是固體,為混合物
B.A 和 F 都能使酸性高錳酸鉀溶液褪色
C.取等質量的 A 和 F 完全燃燒后,生成的 CO2 和 H2O 的質量分別相等
D.取等物質的量的 A 和 F 完全燃燒后,生成的 CO2 和 H2O 的物質的量分別相等
(5)與 E 互為同分異構體,且含有“—COO—”結構的有機物還有____________種。
【答案】 1,2—二溴乙烷 —CH2—CH2— 加成反應 酯化反應 2 CH3CH2OH+ O2 ![]() 2 CH3CHO + 2H2O A、C 5
2 CH3CHO + 2H2O A、C 5
【解析】A是來自石油的重要有機化工原料,對水果有催熟作用,則A為CH2=CH2;75%的B可用于醫用消毒,B為乙醇,A和水發生加成反應生成B為CH3CH2OH;B被催化氧化生成C為CH3CHO,A和溴發生加成反應生成G為CH2BrCH2Br;F是一種高聚物,可制成多種包裝材料,則F為![]() ;E是具有果香味的有機物,B為酸性高錳酸鉀溶液氧化生成D為CH3COOH,CH3COOH與CH3CH2OH發生酯化反應生成E為CH3COOCH2CH3。
;E是具有果香味的有機物,B為酸性高錳酸鉀溶液氧化生成D為CH3COOH,CH3COOH與CH3CH2OH發生酯化反應生成E為CH3COOCH2CH3。
(1)G為CH2BrCH2Br,G的名稱是 1,2-二溴乙烷,F為聚乙烯,鏈節是-CH2-CH2-,故答案為: 1,2-二溴乙烷;-CH2-CH2-;
(2)根據分析,反應①為乙烯與水的加成反應;反應③為乙醇和乙酸的酯化反應,故答案為:加成反應; 酯化反應;
(3)反應②為乙醇的催化氧化,反應的化學方程式為2CH3CH2OH+O2![]() 2CH3CHO + 2H2O,故答案為:2CH3CH2OH+O2
2CH3CHO + 2H2O,故答案為:2CH3CH2OH+O2![]() 2CH3CHO + 2H2O;
2CH3CHO + 2H2O;
(4)A為乙烯,F為聚乙烯。A.乙烯常溫下為氣體,屬于純凈物,聚乙烯,常溫下是固體,聚合度不同,屬于混合物,故A正確;B.聚乙烯沒有碳碳雙鍵,不能使酸性高錳酸鉀溶液褪色,故B錯誤;C.乙烯與聚乙烯的最簡式相同,等質量的乙烯和聚乙烯完全燃燒后,生成的CO2和H2O的質量分別相等,故C正確;D.乙烯與聚乙烯分子中含有碳原子數目不同、氫原子數目不同,取等物質的量的乙烯和聚乙烯完全燃燒后,生成的CO2的物質的量不相等,生成H2O的物質的量也不相等,故D錯誤,故選AC;
(5)E為CH3COOCH2CH3,與E互為同分異構體,且含有“—COO—”結構的有機物還有HCOOCH2CH2CH3,HCOOCH2(CH3)2,CH3CH2COOCH3,CH3CH2CH2COOH,(CH3)2CHCOOH,共5種,故答案為:5。


科目:高中化學 來源: 題型:
【題目】(1)已知2 mol氫氣燃燒生成液態水時放出572 kJ的熱量,反應方程式是2H2(g)+O2(g)===2H2O(l)。請回答下列問題:
(1)①該反應的生成物能量總和________(填“大于”、“小于”或“等于”)反應物能量總和。
②若2 mol氫氣完全燃燒生成水蒸氣,則放出的熱量________(填“>”、“<”或“=”)572 kJ。
(2)FeS2焙燒產生的SO2可用于制硫酸。已知25 ℃、101 kPa時:
2SO2(g)+O2(g) ![]() 2SO3(g) ΔH1=-197 kJ·mol-1
2SO3(g) ΔH1=-197 kJ·mol-1
H2O(g)===H2O(l) ΔH2=-44 kJ·mol-1
2SO2(g)+O2(g)+2H2O(g)===2H2SO4(l) ΔH3=-545 kJ·mol-1
則SO3(g)與H2O(l)反應的熱化學方程式是_________________ 。
(3)已知下列反應的熱化學方程式:
①6C(s)+5H2(g)+3N2(g)+9O2(g)===2C3H5(ONO2)3(l) ΔH1
②2H2(g)+O2(g)===2H2O(g) ΔH2
③C(s)+O2(g)===CO2(g) ΔH3
則反應4C3H5(ONO2)3(l)===12CO2(g)+10H2O(g)+O2(g)+6N2(g)的ΔH為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】元素周期表的形式多種多樣,如圖是扇形元素周期表的一部分(1~36 號元素),對 比中學常見元素周期表思考扇形元素周期表的 填充規律,并用化學用語.回答下列問題:
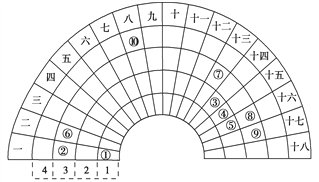
(1)若①~⑩分別代表十種元素,則⑧代表的元素在常見周期表中的位置是____________
(2)比較元素最高價氧化物對應水化物的堿性:②_____________⑥(填“>”或“<”)
(3)寫出一種由①、④、⑤三種元素形成的常見離子化合物:___________,設計一個簡單的實驗檢驗其陽離子的存在:___________________。
(4)用電子式表示⑥、⑨形成化合物的過程:_______________。
(5)①、③、⑤三種元素形成的18 電子結構的化合物是近年來燃料電池研究領域的新寵,寫出用它作燃料,②的最高價氧化物對應的水化物作電解質的燃料電池的負極反應式:_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述中,不正確的是( )
A.在熔化和溶解時均不導電的化合物,叫做非電解質
B.電解質,非電解質都對化合物而言,單質不在此范疇
C.在水中的電解質一定都導電
D.水是極弱的電解質
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】標況下將CO2氣體緩緩地通入到含2 mol KOH、1 mol Ba(OH)2和2 mol KAlO2的混合溶液中直至過量,生成沉淀的物質的量與所通CO2的體積關系如圖所示。下列關于整個反應進程中的各種描述正確的是

A.A~B段和C~D段發生的反應相同
B.B~C段反應的離子方程式是A1O2-+2H2O+CO2=Al(OH)3↓+HCO3-
C.V=134.4 L,n=3mol
D.D點所得溶液中離子濃度的關系為:c(K+)>c(CO32-)>c(OH﹣)>c(HCO3-)>c(H+)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】![]() 是常規核裂變產物之一,可以通過測定大氣或水中
是常規核裂變產物之一,可以通過測定大氣或水中![]() 的含量變化來監測核電站是否發生放射性物質泄漏。下列有關
的含量變化來監測核電站是否發生放射性物質泄漏。下列有關![]() 的敘述中錯誤的是
的敘述中錯誤的是
A. ![]() 的化學性質與
的化學性質與![]() 相同 B.
相同 B. ![]() 的原子序數為53
的原子序數為53
C. ![]() 的原子核外電子數為78 D.
的原子核外電子數為78 D. ![]() 的原子核內中子數多于質子數
的原子核內中子數多于質子數
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知在稀溶液中,強酸跟強堿發生中和反應生成1 mol水時的反應熱叫做中和熱。現利用如圖裝置進行中和熱的測定,請回答下列問題:

(1)該圖中有兩處未畫出,它們是______________、________________。
(2)做一次完整的中和熱測定實驗,溫度計需使用________次。
(3)把溫度為15.0 ℃,濃度為0.5 mol·L-1的酸溶液和0.55 mol·L-1的堿溶液各50 mL混合(溶液密度均為1 g·mL-1),生成溶液的比熱容c=4.18 J · g-1 · ℃-1,輕輕攪動,測得酸堿混合液的溫度變化數據如下:
反應物 | 起始溫度t1/℃ | 終止溫度t2/℃ | 中和熱 |
HCl+NaOH | 15.0 | 18.4 | ΔH1 |
HCl+NH3·H2O | 15.0 | 18.1 | ΔH2 |
①計算上述第一組實驗測出的中和熱ΔH1=______。
②寫出HCl+NH3·H2O的熱化學方程式:____________________________________。
③兩組實驗結果差異的原因是______________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據如圖的轉化關系判斷下列說法正確的是(反應條件已略去)( )

A.反應①②③④⑤均屬于氧化還原反應和離子反應
B.反應⑤說明該條件下鋁的還原性強于錳
C.相同條件下生成等量的O2,反應③和④轉移的電子數之比為1∶1
D.反應①中氧化劑與還原劑的物質的量之比為1∶4
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com