
【題目】H2O2作為氧化劑在反應時不產生污染物被稱為綠色氧化劑,因而受到人們越來越多的關注。為比較Fe3+和Cu2+對H2O2分解的催化效果,某化學研究小組的同學分別設計了如圖甲、乙所示的實驗。請回答下列問題:
(1)定性分析:圖甲可通過觀察_______________________________________定性比較得出結論。有同學提出將FeCl3溶液改為Fe2(SO4)3溶液更合理,其理由是_____________________________。
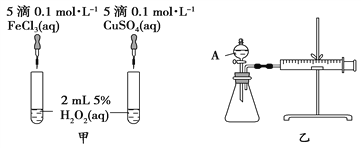
(2)定量分析:如圖乙所示,實驗時均以生成40 mL氣體為準,其他可能影響實驗的因素均已忽略。檢查該裝置氣密性的方法是:關閉A的活塞,將注射器活塞向外拉出一段后松手,過一段時間后看__________________________,實驗中需要測量的數據是____________________________________________________。
(3)課本在研究濃度對反應速率影響的實驗中,酸性高錳酸鉀和弱酸草酸反應的離子方程式為____________________________________________________,反應開始一段時間后反應速率明顯提升的原因是_________________________________________________________________。
【答案】 產生氣泡的快慢 陰離子相同更能說明鐵離子和銅離子的催化效果 注射器活塞是否復原 生成40mL氣體所需要的時間 5H2C2O4十2MnO4--+6H+ = 2Mn2+十10CO2↑十8H2O 反應生成錳離子起催化作用
【解析】(1)該反應中產生氣體,可根據生成氣泡的快慢判斷,氯化鐵和硫酸銅中陰陽離子都不同,無法判斷是陰離子起作用還是陽離子起作用,硫酸鐵和硫酸銅陰離子相同,可以消除陰離子不同對實驗的干擾;
(2)結合乙圖裝置,該氣密性的檢查方法為:關閉分液漏斗活塞,將注射器活塞拉出一定距離,一段時間后松開活塞,觀察活塞是否回到原位;反應是通過反應速率分析的,根據v=![]() ,所以,實驗中需要測量的數據是時間(或收集一定體積的氣體所需要的時間);
,所以,實驗中需要測量的數據是時間(或收集一定體積的氣體所需要的時間);
(3)酸性高錳酸鉀溶液具有強氧化性,能氧化草酸根離子生成二氧化碳,同時自身被還原生成二價錳離子,離子反應方程式為:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O,反應速率提升的原因可能是反應中生成的Mn2+對該反應有催化效果。


科目:高中化學 來源: 題型:
【題目】海洋植物如海帶、海藻中含有豐富的碘元素,碘元素以碘離子的形式存在,實驗室里從海洋植物中提取碘的流程如下: ![]()
某化學興趣小組將上述流程②③設計成如圖所示實驗.
已知:②中發生反應的化學方程式為Cl2+2KI═2KCl+I2 .
(1)寫出提取流程中①③實驗操作的名稱:① , ③ .
(2)四氯化碳是無色、密度比水大的液體.F中下層液體的顏色為色,上層液體中溶質的主要成分為 .
(3)從F中得到碘單質還需進行的操作是 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將下列物質按酸、堿、鹽分類排列,正確的是
A. 硝酸、生石灰、石灰石 B. 醋酸、純堿、食鹽
C. 鹽酸、乙醇、硝酸鉀 D. 硫酸、燒堿、碳酸氫鈉
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,在2L的密閉容器中充入0.4mol SO2和0.2mol O2,發生反應:2SO2(g)+O2(g)![]() 2SO3(g)△H<0,n(O2)隨時間的變化關系如圖實線所示:
2SO3(g)△H<0,n(O2)隨時間的變化關系如圖實線所示:
(1)該溫度下反應的平衡常數K為_______________(不用帶單位),升高溫度K值將_______________(填增大、不變或減小,下同)。
(2)若溫度不變,在容器中再加1mol O2,重新達到平衡,則SO2的平衡濃度將_______________,氧氣的轉化率將_______________,SO3的體積分數將_______________。
(3)僅改變某一實驗條件再進行兩次實驗,測得O2的物質的量隨時間變化如圖中虛線所示,曲線Ⅰ改變的實驗條件是_______________,曲線Ⅱ改變的實驗條件是_______________。
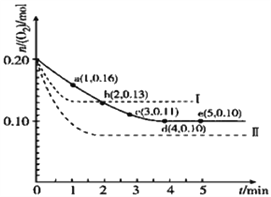
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列電離方程式中正確的是( )
A.HF溶于少量水中:HF+H2OF﹣+H3O+
B.H2S溶于水:H2S2H++S2﹣
C.Na2HPO4溶于水:Na2HPO4═2Na++H++PO43﹣
D.NaHSO4熔融:NaHSO4═Na++H++SO42﹣
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某次實驗需用480mL、0.5mol/L 的稀H2SO4溶液,某同學用98%的濃H2SO4(ρ=1.84g/cm3)進行配制,請回答下列問題:
(1)98%的濃H2SO4(ρ=1.84g/cm3)的物質的量濃度為
(2)將下列步驟中的空格內所用儀器補充填寫完整 ①用20mL量筒量取所需的濃硫酸
②將燒杯中的溶液轉移到mL的容量瓶中
③將濃硫酸緩緩注入盛有適量蒸餾水的燒杯中,邊加邊攪拌
④將溶液冷卻,恢復至室溫
⑤向容量瓶中加入蒸餾水,在距離刻度1~2cm時,改用加蒸餾水至刻度線
⑥蓋好瓶塞,反復上下顛倒,搖勻
⑦洗滌燒杯2~3次,洗滌液也注入容量瓶中.輕輕搖動容量瓶,使溶液混合均勻.
(3)實驗中上述步驟的正確順序為(填序號).
(4)填寫下列各種情況對所配制溶液濃度的影響(選填“偏高”、“偏低”或“無影響”). ①所用的濃硫酸長時間放置在密封不好的容器中
②量取濃硫酸所用量筒有蒸餾水
③定容時,俯視液面
(5)取用任意體積的所配0.5mol/L硫酸溶液時,下列物理量中不隨所取體積的多少而變化的是(填字母)
A.溶液中H2SO4的物質的量
B.溶液的濃度
C.溶液中SO42﹣的數目
D.溶液的密度
(6)在容量瓶上,下列標記不存在的是(填字母)
A.標線
B.溫度
C.濃度
D.容量規格.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】標準狀況下將44.8LHCl氣體溶于1L水中,所得鹽酸溶液的密度為1.1g/cm3,該鹽酸的物質的量濃度為
A. 2mol/L B. 2.1mol/L C. 2.2mol/L D. 2.3mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】T℃時,在容積為2L的3個恒容密閉容器中發生反應:3A(g)+B(g)![]() xC(g),按不同方式投入反應物,測得反應達到平衡時的有關數據如下:
xC(g),按不同方式投入反應物,測得反應達到平衡時的有關數據如下:
容器 | 甲 | 乙 | 丙 |
反應物的投入量 | 3molA、2molB | 6molA、4molB | 2molC |
還到平衡的時間/min | 5 | 8 | |
A的濃度/mol L-1 | cl | c2 | O |
C的體積分數/% | ω1 | ω3 | |
混合氣體的密度/g·L-1 | ρ1 | ρ2 |
下列說法正確的是
A. 若x<4,則2c1<c2
B. 若x=4,則ω1=ω3
C. 無論x的值是多少,均有2ρ1=ρ2內
D. 容器甲中反應從開始到平衡的平均反應速率可能為v(A)=0.3mol·L-1·min-1
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com