
【題目】下列營養物質中,屬于高分子的是
A. 蔗糖 B. 油脂 C. 蛋白質 D. 葡萄糖
科目:高中化學 來源: 題型:
【題目】我國古代就有濕法煉銅的記載“曾青得鐵則化為銅”,反應為Fe+CuSO4=FeSO4+Cu。有關該反應的說法正確的是 ( )
A. Fe被氧化 B. CuSO4是還原劑
C. Fe是氧化劑 D. CuSO4發生氧化反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z、W四種常見元素,其中X、Y、Z為短周期元素,W為過渡元素,它們的相關信息如表:
原子或分子相關信息 | 單質及其化合物相關信息 | |
X | ZX4分子是由粗Z提純Z的中間產物 | X的最高價氧化物對應的水化物為無機酸中最強酸 |
Y | Y原子的最外層電子數等于電子層數 | Y的氧化物是典型的兩性氧化物,可用于制造一種高溫材料 |
Z | Z原子的最外層電子數是次外層電子數的 | Z廣泛存在于無機非金屬材料中,其單質是制取大規模集成電路的主要原料 |
W | W原子的最外層電子數小于4 | W的常見化合價有+3、+2,WX3稀溶液呈黃色 |
回答下列問題:
(1)W在周期表的位置為 , W(OH)2在空氣中不穩定,極易被氧化反應的化學方程式為 .
(2)X的簡單陰離子的結構示意圖為;X的最高價氧化物對應水化物的水溶液與Y的氧化物反應的離子方程式為 .
(3)Z的氧化物在通訊領域的用途是 , 工業上制備Z的單質的化學反應方程式為 .
(4)YX3固體在熔融狀態下不導電,則YX3固體中存在鍵;在50mL 1molL﹣1的YX3溶液中逐滴加入0.5molL﹣1的NaOH溶液,得到1.56g沉淀,則加入NaOH溶液的體積可能有種情況.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組離子能大量共存,且強酸性溶液中也能大量共存的一組是
A. K+、Na+、ClO―、SO42― B. Mg2+、Al3+、NO3―、SO42―
C. Na+、CO32―、Cu2+、K+ D. Fe2+、K+、Cl―、NO3―
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用鹽酸和硝酸銀探究鐵、銅、銀的金屬活動順序,下列實驗可以不需要進行的是( )
A. 鐵+稀鹽酸 B. 銅+稀鹽酸 C. 銀+稀鹽酸 D. 銅+硝酸銀溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度下,濃度都是1mol·L﹣1的兩種氣體X2和Y2,在密閉容器中發生反應生成氣體Z,反應2min后,測得參加反應的X2的濃度為0.6mol·L﹣1,用Y2的濃度變化表示的化學反應速率v(Y2)=0.1mol·L﹣1·min﹣1,生成的c(Z)為0.4mol/L.則該反應的化學方程式是( )
A. X2+2Y2![]() 2Z B. 2X2+Y2
2Z B. 2X2+Y2![]() 2Z C. 3X2+Y2
2Z C. 3X2+Y2![]() 2Z D. X2+3Y2
2Z D. X2+3Y2![]() 2Z
2Z
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】砷(As)是第33號元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有著廣泛的用途。回答下列問題:
(1)砷在元素周期表中的位置是__________________________。
(2)工業上常將含砷廢渣(主要成分為As2S3)制成漿狀,通入O2氧化,生成H3AsO4和單質硫。寫出發生反應的化學方程式_________________________________________。該反應需要在加壓下進行,原因是__________________________。
(3)已知:2As(s)+3H2(g)+4O2(g)=2H3AsO4(s)△H1
H2(g)+ ![]() O2(g)=H2 O(l) △H2
O2(g)=H2 O(l) △H2
2As(s)+ ![]() O2(g) =As2O5(s)△H3
O2(g) =As2O5(s)△H3
則反應 As2O5(s) +3H2O(1)= 2H3AsO4(s)的△H=____________。
(4)298K時,將20mL3xmol·L-1Na3AsO3、20 mL 3xmol·L-1I2和20mL NaOH溶液混合,發生反應:AsO33-(aq)+I2+2OH-![]() AsO43-+2I-+H2O。溶液中c(AsO43-) 與反應時間(t)的關系如圖所示。
AsO43-+2I-+H2O。溶液中c(AsO43-) 與反應時間(t)的關系如圖所示。
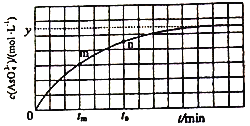
①下列不能判斷反應達到平衡的是________(填標號)。
a.溶液的pH不再變化 b.v(I-)=2v(AsO33-)
c.c(AsO43-)/c(AsO33-)不再變化 d.c(I-)=ymol·L-1
②tm時v逆 ______tn時v逆(填“>”“<”或“=”),理由是_____________。
③若平衡時溶液的c(OH-)=lmol/L,則該反應的平衡常數K為____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度時,在一個容積為2L的密閉容器中,X、Y、Z三種物質的物質的量隨時間的變化曲線如圖所示. 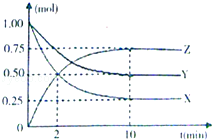
根據圖中數據,完成下列問題:
(1)該反應的化學方程;
(2)反應開始至2min,氣體Z的平均反應速率為;
(3)若X、Y、Z均為氣體,則反應起始時與平衡后的壓強之比是 .
(4)達到平衡后,下列說法不正確的是
A.X、Y、Z的濃度之比是1:2:3
B.X的消耗速率和Y的生成速率相等
C.Z的濃度保持不變
D.升高溫度重新達到平衡,Z的濃度減小,則該反應為吸熱反應.
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com