
【題目】開發使用清潔能源,發展“低碳經濟”正成為科學家研究的主要課題。氫氣、甲醇是優質的清潔燃料,可制作燃料電池。
(1)甲烷水蒸氣轉化法制H2的主要轉化反應如下:
CH4(g)+ H2O(g)![]() CO(g)+3H2(g) △H=+206.2kJ·mol-1
CO(g)+3H2(g) △H=+206.2kJ·mol-1
CH4(g)+2H2O(g)![]() CO2(g)+4H2(g) △H=+165.0 kJ·mol-1
CO2(g)+4H2(g) △H=+165.0 kJ·mol-1
上述反應所得原料氣中的CO能使合成氨的催化劑中毒,必須除去。工業上常采用催化劑存在下CO與水蒸氣反應生成易除去的CO2,同時可制得等體積的氫氣的方法。此反應稱為一氧化碳變換反應,該反應的熱化學方程式是__________________。
(2)生產甲醇的原料CO和H2來源于:CH4(g) + H2O(g)![]() CO(g) + 3H2(g) △H>0,100°C時,將1 mol CH4和2 mol H2O通入容積為1 L的定容密封容器中,發生反應,能說明該反應己經達到平衡狀態的是_________________。
CO(g) + 3H2(g) △H>0,100°C時,將1 mol CH4和2 mol H2O通入容積為1 L的定容密封容器中,發生反應,能說明該反應己經達到平衡狀態的是_________________。
a.容器內氣體密度恒定
b.單位時間內消耗0.1 mol CH4同時生成0.3 mol H2
c.容器的壓強恒定
d.3v正(CH4) = v逆(H2)
(3)25°C時,在20mL0.lmol/L 氫氟酸中加入VmL0.lmol/LNaOH 溶液,測得混合溶液的pH變化曲線如圖所示,下列說法正確的是_____________。

A.pH=3的HF溶液和pH=11的NaF溶液中,由水電離出的c(H+)相等
B.①點時pH=6,此時溶液中,c(F-)-c(Na+)=9. 9×10-7mol/L
C.②點時,溶液中的c(F- )=c(Na+)
D.③點時V=20mL,此時溶液中c(Na+)=0. lmol/L
(4)長期以來,一直認為氟的含氧酸不存在。1971年美國科學家用氟氣通過細冰末時獲得HFO,其結構式為H-O-F。HFO與水反應得到HF和化合物A,該反應的化學方程式為___________________。
【答案】 CO(g) + H2O(g)![]() CO2(g)+ H2(g) △H=-41.2 kJ·mol-1 cd BC H2O+HFO=HF+H2O2
CO2(g)+ H2(g) △H=-41.2 kJ·mol-1 cd BC H2O+HFO=HF+H2O2
【解析】本題考查熱化學反應方程式的書寫、化學平衡狀態的判斷、離子濃度大小比較,(1)①CH4(g)+ H2O(g) ![]() CO(g)+3H2(g),②CH4(g)+2H2O(g)
CO(g)+3H2(g),②CH4(g)+2H2O(g)![]() CO2(g)+4H2(g),CO和水蒸氣反應方程式為CO+H2O=CO2+H2,②-①得出:CO(g)+H2O(g)=CO2(g)+H2(g) △H=(165.0-206.2)kJ·mol-1=-41.2kJ·mol-1;(2)a、組分都是氣體,則氣體質量不變,容器為恒容狀態,則氣體V不變,根據密度的定義,密度任何一時刻都相等,即密度不變不能作為達到平衡的標志,故a錯誤;b、消耗甲烷,生成氫氣,化學反應向正反應方向進行,不能說明反應達到平衡,故b錯誤;c、反應前后氣體系數之和不相等,因此當壓強不再改變,說明反應達到平衡,故c正確;d、v正(CH4)說明反應向正反應進行,v逆(H2)說明反應向逆反應進行,且兩者速率之比等于化學計量數之比,因此能說明反應達到平衡,故d正確;(3)A、pH=3的HF溶液中c(OH-)=10-11mol·L-1,HF為弱酸,OH-是由水電離產生,因此HF溶液中水電離出c(H+)=10-11,NaF屬于強堿弱酸鹽,F-發生水解,結合水電離出H+,因此NaF溶液中水電離出c(OH-)=10-3mol·L-1,即水電離出c(H+)=10-3mol·L-1,因此兩種溶液中水電離出c(H+)不同,故A錯誤;B、根據電荷守恒,c(Na+)+c(H+)=c(OH-)+c(F-),得出c(F-)-c(Na+)=c(H+)-c(OH-)=10-6-10-8=9.9×10-7mol·L-1,故B正確;C、根據電荷守恒,c(Na+)+c(H+)=c(OH-)+c(F-),②點pH=7,即c(H+)=c(OH-),得出c(Na+)=c(F-),故C正確;D、混合后,n(Na+)=20×10-3×0.1mol=2×10-3mol,混合后c(Na+)=2×10-3/(20+20)×10-3mol·L-1=0.05mol·L-1,故D錯誤;(4)根據信息,推出HFO+H2O→HF+A,HFO中H顯+1價,O顯0價,F顯-1價,根據元素守恒,推出A為H2O2,即化學反應方程式為HFO+H2O=HF+H2O2。
CO2(g)+4H2(g),CO和水蒸氣反應方程式為CO+H2O=CO2+H2,②-①得出:CO(g)+H2O(g)=CO2(g)+H2(g) △H=(165.0-206.2)kJ·mol-1=-41.2kJ·mol-1;(2)a、組分都是氣體,則氣體質量不變,容器為恒容狀態,則氣體V不變,根據密度的定義,密度任何一時刻都相等,即密度不變不能作為達到平衡的標志,故a錯誤;b、消耗甲烷,生成氫氣,化學反應向正反應方向進行,不能說明反應達到平衡,故b錯誤;c、反應前后氣體系數之和不相等,因此當壓強不再改變,說明反應達到平衡,故c正確;d、v正(CH4)說明反應向正反應進行,v逆(H2)說明反應向逆反應進行,且兩者速率之比等于化學計量數之比,因此能說明反應達到平衡,故d正確;(3)A、pH=3的HF溶液中c(OH-)=10-11mol·L-1,HF為弱酸,OH-是由水電離產生,因此HF溶液中水電離出c(H+)=10-11,NaF屬于強堿弱酸鹽,F-發生水解,結合水電離出H+,因此NaF溶液中水電離出c(OH-)=10-3mol·L-1,即水電離出c(H+)=10-3mol·L-1,因此兩種溶液中水電離出c(H+)不同,故A錯誤;B、根據電荷守恒,c(Na+)+c(H+)=c(OH-)+c(F-),得出c(F-)-c(Na+)=c(H+)-c(OH-)=10-6-10-8=9.9×10-7mol·L-1,故B正確;C、根據電荷守恒,c(Na+)+c(H+)=c(OH-)+c(F-),②點pH=7,即c(H+)=c(OH-),得出c(Na+)=c(F-),故C正確;D、混合后,n(Na+)=20×10-3×0.1mol=2×10-3mol,混合后c(Na+)=2×10-3/(20+20)×10-3mol·L-1=0.05mol·L-1,故D錯誤;(4)根據信息,推出HFO+H2O→HF+A,HFO中H顯+1價,O顯0價,F顯-1價,根據元素守恒,推出A為H2O2,即化學反應方程式為HFO+H2O=HF+H2O2。


 同步練習西南大學出版社系列答案
同步練習西南大學出版社系列答案 補充習題江蘇系列答案
補充習題江蘇系列答案 學練快車道口算心算速算天天練系列答案
學練快車道口算心算速算天天練系列答案科目:高中化學 來源: 題型:
【題目】葡萄糖是人類的營養物質,在人體里富氧條件下氧化生成CO2和水;在缺氧條件下生成一種有機酸A。
已知: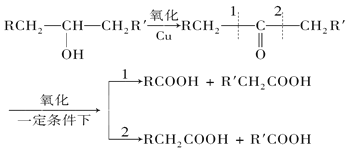
將A進行如下圖所示的反應,其中C和C’是同系物,C’是甲酸(HCOOH),F為高分子化合物。
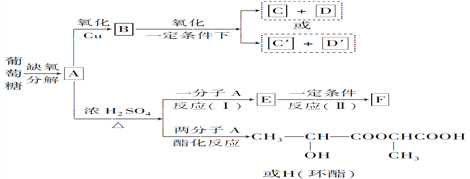
回答下列問題:
(1)C和D′屬于________(用編號填入,以下同)。
①同系物 ②同分異構體 ③同類物質 ④同素異形體
(2)D′和E分別屬于哪一類化合物?D′________,E________。
①多元醇 ②醛 ③不飽和羧酸 ④多元羧酸 ⑤酯
(3)寫出結構簡式:A______________,F______________,H____________________。
(4)寫出反應類型:(Ⅰ)___________________,(Ⅱ)______________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子在溶液中可以大量共存的一組是 ( )
A. Mg2+ Na+ OH- B. Al3+ NO3- Cl-
C. K+ H+ HCO3- D. Mg2+ Ca2+ SO42-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】還原沉淀法是處理含鉻(含Cr2O72﹣和CrO42﹣)工業廢水的常用方法,過程如下:
CrO42﹣ ![]() Cr2O72﹣
Cr2O72﹣ ![]() Cr3+
Cr3+ ![]() Cr(OH)3↓
Cr(OH)3↓
己知轉化過程中的反應為:2CrO42﹣(aq)+2H+(aq)═Cr2O72﹣(aq)+H2O(1).轉化后所得溶液中鉻元素含量為28.6g/L,CrO42﹣有10/11轉化為Cr2O72﹣ . 下列說法不正確的是( )
A.轉化過程中,增大c(H+),平衡向正反應方向移動,CrO42﹣的轉化率提高
B.常溫下Ksp[Cr(OH)3]=1×10﹣32 , 要使處理后廢水中c(Cr3+)降至1×10﹣5mol/L,應調溶液的pH=5
C.若用綠礬(FeSO47H2O)(M=278)作還原劑,處理1L廢水,至少需要917.4g
D.常溫下轉化反應的平衡常數K=104 , 則轉化后所得溶液的pH=1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Fenton試劑常用于氧化降解有機污染物X。在一定條件下,反應初始時c(X)=2.0×10-3mol·L-1,反應10 min進行測定,得圖1和圖2。下列說法不正確的是
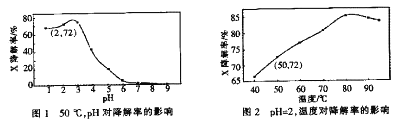
A. 50oC,PH在3~6之間,X降解率隨pH增大而減小
B. pH=2,溫度在40~80oC,X降解率隨溫度升高而增大
C. 無需再進行后續實驗,就可以判斷最佳反應條件是:PH=3、溫度為80oC
D. pH=2、溫度為50oC,10min內v(X)=1.44x10-4mol·L-1min-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】反應A (g)+B (s)![]() C(g); ΔH<0,在其他條件不變時,改變其中一個條件,則生成C的速率(填“加快”、“ 減慢”或“不變”)。
C(g); ΔH<0,在其他條件不變時,改變其中一個條件,則生成C的速率(填“加快”、“ 減慢”或“不變”)。
(1)升溫____________;
(2)加正催化劑______________;
(3)增大容器容積___________;
(4)加入C_________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某無色溶液甲中僅含有下列離子的幾種( 不考慮水的電離以及離子的水解);
陽離子 | K+、Al3+、Fe3+、Ba2+、NH4+ |
陰離子 | Cl-、CO32-、HCO3-、SO42- |
取100mL溶液甲并分成兩等份進行如下實驗(假設每步完全反應):
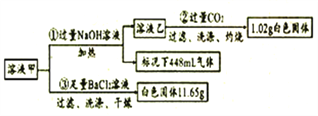
(1)由①可知,原溶液存在的離子有____,濃度為_____mol/L。
(2)寫出實驗②中生成沉淀的離子方程式_________。
(3)通入過量CO2充分反應后,需將反應后的混合溶液加熱再過濾,其目的是_______。
(4)某同學通過分析認為該溶液中一定存在K+,其理由是________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列指定反應的離子方程式正確的是 ( )
A. 鈉與水反應: Na +2H2O![]() Na++2OH- + H2↑
Na++2OH- + H2↑
B. 將少量Na2O2固體加入過量Ba(HCO3)2溶液中:2Na2O2+4Ba2++4HCO3-=4BaCO3↓+2H2O+O2↑+4Na+
C. 向氫氧化鋇溶液中加入稀硫酸: Ba2++OH- + H+ + SO42- ![]() BaSO4↓+H2O
BaSO4↓+H2O
D. 向碳酸氫銨溶液中加入足量石灰水: Ca2++ HCO3-+OH-![]() CaCO3↓+H2O
CaCO3↓+H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】核黃素又稱為維生素B2,可促進發育和細胞再生,有利于增進視力,減輕眼睛疲勞.核黃素分子的結構為 ,已知:
,已知:![]() ,有關核黃素的下列說法中,不正確的是
,有關核黃素的下列說法中,不正確的是
A. 該化合物的分子式為C17H22N4O6
B. 酸性條件下加熱水解,有CO2生成
C. 酸性條件下加熱水解,所得溶液加堿后有NH3生成
D. 能發生酯化反應
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com