
【題目】在一個容積為3L的密閉容器里進行如下反應N2(g)+3H2(g)2NH3(g),反應開始時n(N2)=1.5mol,n(H2)=4.4mol,2min末n(H2)=0.8mol.求:
(1)試用H2 , N2和NH3的濃度分別表示該反應的反應速率;
(2)求出2min末N2的濃度.
【答案】
(1)解:在一個容積為3L的密閉容器里,反應開始時n(N2)=1.5mol,n(H2)=4.4mol,2min末n(H2)=0.8mol,則:
N2(g)+ | 3H2(g) | 2NH3(g) | ||
起始量(mol): | 1.5 | 4.4 | 0 | |
變化量(mol): | 0.4 | 1.2 | 0.8 | |
2min末(mol): | 1.1 | 3.2 | 0.8 |
v(H2)= ![]() =0.2mol/(L.min);
=0.2mol/(L.min);
v(N2)= ![]() =0.067mol/(L.min);
=0.067mol/(L.min);
v(NH3)= ![]() =0.133mol/(L.min),
=0.133mol/(L.min),
答:v(H2)=0.2mol/(L.min),v(N2)=0.067mol/(L.min),v(NH3)=0.133mol/(L.min)
(2)解:2min末N2的濃度為 ![]() =0.37mol/L,答:2min末N2的濃度為0.37mol/L
=0.37mol/L,答:2min末N2的濃度為0.37mol/L
【解析】在一個容積為3L的密閉容器里,反應開始時n(N2)=1.5mol,n(H2)=4.4mol,2min末n(H2)=0.8mol,則:
N2(g)+ | 3H2(g) | 2NH3(g) | ||
起始量(mol): | 1.5 | 4.4 | 0 | |
變化量(mol): | 0.4 | 1.2 | 0.8 | |
2min末(mol): | 1.1 | 3.2 | 0.8 |
(1.)根據v= ![]() 計算用H2、N2和NH3的濃度分別表示該反應的反應速率;(2.)根據c=
計算用H2、N2和NH3的濃度分別表示該反應的反應速率;(2.)根據c= ![]() 計算2min末N2的濃度.
計算2min末N2的濃度.
【考點精析】本題主要考查了化學平衡的計算的相關知識點,需要掌握反應物轉化率=轉化濃度÷起始濃度×100%=轉化物質的量÷起始物質的量×100%;產品的產率=實際生成產物的物質的量÷理論上可得到產物的物質的量×100%才能正確解答此題.


科目:高中化學 來源: 題型:
【題目】下列情況會對人體健康造成較大危害的是( )
A.自來水中通入少量Cl2進行消毒殺菌
B.利用SO2的漂白作用使食品增白
C.用食醋清洗熱水瓶膽內壁附著的水垢(CaCO3)
D.用小蘇打(NaHCO3)發酵面團制作饅頭
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學在做濃硫酸與銅反應的實驗過程中,觀察到銅片表面變黑,于是對黑色物質的組成進行實驗探究。
(1)用如右圖所示裝置進行實驗1。(加熱和夾持儀器已略去)

實驗1:銅片與濃硫酸反應
操作 | 現象 |
加熱到120℃~250℃ | 銅片表面變黑,有大量氣體產生,形成墨綠色濁液 |
繼續加熱至338℃ | 銅片上黑色消失,瓶中出現“白霧”,溶液略帶藍色,瓶底部有較多灰白色沉淀 |
①裝置B的作用是________;裝置C中盛放的試劑是_______。
②為證明A裝置中灰白色沉淀的主要成分為硫酸銅,實驗操作及現象是___________。
(2)探究實驗1中120℃~250℃時所得黑色固體的成分。
【提出猜想】黑色固體中可能含有CuO、CuS、Cu2S中的一種或幾種。
【查閱資料】
資料1:亞鐵氰化鉀[K4Fe(CN)6]是Cu2+的靈敏檢測劑,向含有Cu2+的溶液中滴加亞鐵氰化鉀溶液,生成紅棕色沉淀。
資料2:
CuS | Cu2S |
黑色結晶或粉末 | 灰黑色結晶或粉末 |
難溶于稀硫酸;可溶于硝酸;微溶于濃氨水或熱的濃鹽酸 | 難溶于稀硫酸和濃鹽酸;可溶于硝酸;微溶于濃氨水 |
【設計并實施實驗】
實驗2.探究黑色固體中是否含CuO
操作 | 現象 |
i.取表面附著黑色固體的銅片5片,用清水洗干凈,放入盛有10mL試劑A的小燒杯中,攪拌 | 黑色表層脫落,露出光亮的銅片 |
ii.取出銅片,待黑色沉淀沉降 | 上層溶液澄清、無色 |
①試劑A是_________。
②甲認為ii中溶液無色有可能是Cu2+濃度太小,于是補充實驗確認了溶液中不含Cu2+,補充的實驗操作及現象是______。
實驗3.探究黑色固體中是否含CuS、Cu2S
操作 | 現象 |
i.取實驗2中黑色固體少許,加入適量濃氨水,振蕩后靜置 | 有固體剩余,固液分界線附近的溶液呈淺藍色 |
ii.另取實驗2中黑色固體少許,加入適量濃鹽酸,微熱后靜置 | 有固體剩余,溶液變成淺綠色 |
【獲得結論】由實驗2和實驗3可得到的結論是:實驗1中,120℃~250℃時所得黑色固體中_______。
【實驗反思】
分析實驗1中338℃時產生現象的原因,同學們認為是較低溫度時產生的黑色固體與熱的濃硫酸進一步反應造成。已知反應的含硫產物除無水硫酸銅外還有二氧化硫,則黑色固體消失時可能發生的所有反應的化學方程式為_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】控制變量法是化學實驗的一種常用方法.下表是某學習小組研究等物質的量濃度的稀硫酸和鋅反應的實驗數據,分析以下數據,回答下列問題:
序號 | 硫酸的體積/mL | 鋅的質量/g | 鋅的性狀 | 溫度/ | 完全溶于酸的時間/s | 生成硫酸鋅的質量/g |
1 | 50.0 | 2.0 | 薄片 | 25 | 100 | m1 |
2 | 50.0 | 2.0 | 顆粒 | 25 | 70 | m2 |
3 | 50.0 | 2.0 | 顆粒 | 35 | 35 | m3 |
4 | 50.0 | 2.0 | 粉末 | 25 | 45 | 5.0 |
5 | 50.0 | 6.0 | 粉末 | 35 | 30 | m4 |
6 | 50.0 | 8.0 | 粉末 | 25 | t6 | 16.1 |
7 | 50.0 | 10.0 | 粉末 | 25 | t7 | 16.1 |
(1)化學反應速率本質上是由決定的,但外界條件也會影響反應速率的大小.本實驗中實驗2和實驗3表明對反應速率有影響.
(2)我們最好選取實驗(填3個實驗序號)研究鋅的形狀對反應速率的影響.我們發現在其它條件相同時,反應物間的反應速率越快.
(3)若采用與實驗1完全相同的條件,但向反應容器中滴加少量硫酸銅溶液,發現反應速率明顯加快.原因是 .
(4)利用表中數據,可以求得:硫酸的物質的量濃度是mol/L.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示,組成一種原電池.試回答下列問題(燈泡功率合適): 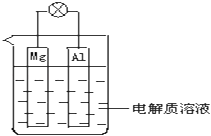
(1)電解質溶液為稀H2SO4時,燈泡(填“亮”或“不亮”,填“亮”做a題,填“不亮”做b題). a.若燈泡亮,則Mg電極上發生的反應為:;Al電極上發生的反應為:
b.若燈泡不亮,其理由為:.
(2)電解質溶液為NaOH(aq)時,燈泡(填“亮”或“不亮”,填“亮”做a題,填“不亮”做b題). a.若燈泡亮,則Mg電極上發生的反應為:;Al電極上發生的反應為:
b.若燈泡不亮
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】從廢電池外殼中回收鋅(鋅皮中常有少量鐵、外表沾有NH4Cl、ZnCl2、MnO2等雜 質),制取ZnSO4·7H2O可以采取如下工藝流程:

已知:①Zn(OH)2和Al(OH)3化學性質相似;②金屬氫氧化物沉淀的pH:
氫氧化物 | 開始沉淀的pH | 完全沉淀的pH |
Zn(OH)2 | 5.7 | 8.0 |
Fe(OH)3 | 2.7 | 3.7 |
請回答下列問題:
(1) “酸溶”時,為了提高酸溶速率,可采取的的措施有:______________(任答一點)。
(2)“氧化”時,酸性濾液中加入NaNO2反應的離子方程式為______________。
(3) “氧化”時,為了減少污染,工業上常用H2O2替代NaNO2。
①若參加反應的NaNO2為0.2 mol,對應則至少需要加入10%H2O2溶液_______________mL(密度近似為1g·cm-3)。
②該過程中加入的H2O2需多于理論值,原因除了提高另外反應物的轉化率外,還可能是_____________。
(4) “調節pH”時,若pH>8則造成鋅元素沉淀率降低,其原因可能是________________。
(5)將濾渣A溶于適量稀硫酸,調節溶液pH,過濾,將濾液蒸發濃縮,冷卻結晶析出ZnSO4·7H2O晶體。則該過程中需調節溶液pH的范圍為_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用NA表示阿伏加德羅常數的數值,下列說法正確的是
A. 反應Cu2S+O2![]() 2Cu+SO2生成1molCu,電子轉移數為3NA
2Cu+SO2生成1molCu,電子轉移數為3NA
B. 常溫時,2L1mol/L的醋酸溶液中,所含分子總數小于2 NA
C. 1molFeC13溶于水中,溶液中離子數為4 NA
D. 1molNH2-中含電子數為NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中正確的是
A.原子及其離子的核外電子層數等于該元素所在的周期數;
B.元素周期表中從ⅢB族到ⅡB族10個縱行的元素都是金屬元素;
C稀有氣體原子的最外層電子數都是8;
D.同一元素的各種同位素的物理性質、化學性質均相同
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com