
【題目】已知有如圖所示物質的相互轉化:
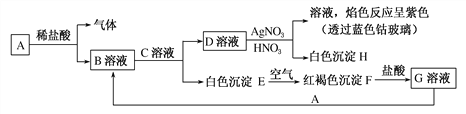
試填寫下列空白:
(1)寫出下列物質的化學式:A________,C________。
(2)B中金屬陽離子的檢驗方法為___________________________________________。
(3)D生成H的離子方程式為____________________________________。
(4)寫出由E轉變成F的化學方程式:_________________________________________。
【答案】 Fe KOH 先向B溶液中滴入幾滴KSCN溶液,溶液不變色,再向該溶液中通入氯氣(或滴入雙氧水),溶液變為血紅色,說明B中含有亞鐵離子(或其他合理答案) Ag++Cl-===AgCl↓ 4Fe(OH)2+O2+2H2O===4Fe(OH)3
【解析】試題分析:根據![]() ,可知E是Fe(OH)2、F是Fe(OH)3;Fe(OH)3和鹽酸反應生成G,G是FeCl3;綜合分析,A是Fe,Fe與鹽酸反應生成FeCl2和氫氣;根據
,可知E是Fe(OH)2、F是Fe(OH)3;Fe(OH)3和鹽酸反應生成G,G是FeCl3;綜合分析,A是Fe,Fe與鹽酸反應生成FeCl2和氫氣;根據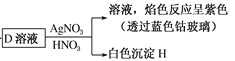 ,可知H是AgCl ,D是KCl;FeCl2與C反應生成KCl、Fe(OH)2,則C是KOH。
,可知H是AgCl ,D是KCl;FeCl2與C反應生成KCl、Fe(OH)2,則C是KOH。
解析:根據以上分析,(1) A是Fe,C是KOH;(2) FeCl2中Fe2+金屬陽離子是的檢驗方法是先向B溶液中滴入幾滴KSCN溶液,溶液不變色,再向該溶液中通入氯氣,溶液變為血紅色,說明B中含有亞鐵離子。
(3) KCl與硝酸銀生成氯化銀的離子方程式為Ag++Cl-===AgCl↓。
(4) Fe(OH)2氧化為Fe(OH)3的化學方程式4Fe(OH)2+O2+2H2O===4Fe(OH)3。


 智慧小復習系列答案
智慧小復習系列答案科目:高中化學 來源: 題型:
【題目】下列關于乙烯的說法中,不正確的是( )
A. 是無色氣體,比空氣略輕,難溶于水
B. 與溴水發生取代反應而使溴水褪色
C. 乙烯的產量標志著一個國家的石油化工水平
D. 可用點燃法鑒別乙烯和甲烷
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有關水在人體中的作用,下列說法中正確的是 ( )
A、水不是一種很好的溶劑 B、水在人體內還有調節體溫的作用
C、飲用水越純凈越好 D、沒有污染的水就是純凈水
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于現在的長式元素周期表的說法中正確的是( )
A.從左向右數第六縱行是ⅥA族
B.七個周期18個族
C.ⅠA族全部是金屬元素
D.所含元素種類最多的族是ⅢB族
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碳酸亞鐵(FeCO3)是菱鎂礦的主要成分,將FeCO3加熱到200℃開始分解為FeO和CO2,若在空氣中高溫煅燒FeCO3生成Fe2O3。
I.已知25℃,101kPa時:4Fe(s)+3O2(g)=2Fe2O3(s) △H=-1648kJ/mol
C(s)+ O2(g)=CO2(g) △H=-393 kJ/mol 2FeCO3(s)=2Fe(s)+ 3O2(g) △H=+148OkJ/mol
(1)請寫出FeCO3在空氣中煅燒生成Fe2O3的熱化學方程式_______。
Ⅱ.生成的FeO和Fe2O3在一定條件下被還原為金屬鐵。
(2)據報道一定條件下Fe2O3可被甲烷還原為“納米級”的金屬鐵。其反應為:
Fe2O3(s)+3CH4(g)=2Fe(s)+3CO(g)+6H2(g) △H>0
① 原子序數為26的鐵元素位于元素周期表的第_______周期。
②反應在5L的密閉容器中進行,2min后達到平衡,測得Fe2O3在反應中質量消耗4.8g。則該段時間內用H2表達的平均反應速率為____________。
③將一定量的Fe2O3(s)和一定量的CH4(g)置于恒溫恒壓容器中,在一定條件下反應,能表明該反應達到平衡狀態的是___________。
a.CH4的轉化率等于CO的產率 b.混合氣體的平均相對分子質量不變
c.v正(CO):v逆(H2)=1:2 d.固體的總質量不變
(3)FeO可用CO進行還原,已知:t℃時,FeO(s)+CO(g)![]() Fe(s)+CO2(g),K=0.5,若在1L密閉容器中加入0.04mol FeO(s),并通入xmolCO,t℃時反應達到平衡。此時FeO(s)的轉化率為50%,則x=_______。
Fe(s)+CO2(g),K=0.5,若在1L密閉容器中加入0.04mol FeO(s),并通入xmolCO,t℃時反應達到平衡。此時FeO(s)的轉化率為50%,則x=_______。
Ⅲ. Fe2O3還可用來制備FeCl3,FeCl3在水溶液中的水解分三步:
Fe3++H2O![]() Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++ H2O![]() Fe(OH)2++H+ K2
Fe(OH)2++H+ K2
Fe(OH)2++ H2O![]() Fe (OH)3+H+ K3
Fe (OH)3+H+ K3
(4)以上水解反應的平衡常效K1、K2、K3由大到小的順序是_______。通過控制條件,以上水解產物聚合生成聚合物的離子方程式為:xFe3++yH2O===Fex(OH)y(3x-y)++yH+
欲使平衡正向移動可采用的方法是__________(填字母)
a.加水稀釋 b.加入少量NaCl固體 c.升溫 d.加入少量Na2CO3固體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有機化合物J是治療心臟病藥物的一種中間體,分子結構中含有3個六元環。其中一種合成路線如下:
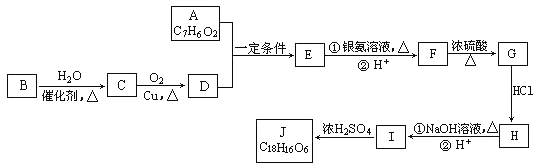
已知:
①A既能發生銀鏡反應,又能與FeCl3溶液發生顯色反應,其核磁共振氫譜顯示有4種氫,且峰面積之比為1︰2︰2︰1。
②有機物B是一種重要的石油化工產品,其產量可用來衡量國家的石油化工發展水平。
③![]()
回答以下問題:
(1)A中含有的官能團名稱是_________________________________。
(2)寫出有機反應類型B→C__________,F→G_________,I→J_________。
(3)寫出F生成G的化學方程式____________________________________。
(4)寫出J的結構簡式__________________________________。
(5)E的同分異構體有多種,寫出所有符合以下要求的E的同分異構體的結構簡式_____________。
①FeCl3溶液發生顯色反應 ②能發生銀鏡反應
③苯環上只有兩個對位取代基 ④能發生水解反應。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用固體NaOH配制物質的量濃度溶液時,下列操作會導致溶液濃度偏高的是( )
A. 在燒杯中溶解時,有少量液體濺出 B. 樣品中含有少量Na2O雜質
C. 容量瓶使用前未干燥 D. 定容時仰視視容量瓶刻度線
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組物質,按化合物、單質、混合物的順序排列的是( )
A. 燒堿、液態氧、碘酒 B. 生石灰、白磷、熟石灰
C. 干冰、鐵、氯化氫 D. 空氣、氮氣、膽礬
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)已知:2SO2(g)+ O2(g)= 2SO3(g) △H =-196.6kJ·mol-1
2NO(g)+O2=2NO2(g) △H =-113.0kJ·mol-1
則反應NO2(g)+SO2(g)=SO3(g)+NO(g)的△H = __________。
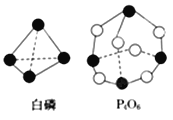
(2)化學反應可視為舊鍵斷裂和新鍵形成的過程。化學鍵的鍵能是形成(或拆開)1mol化學鍵時釋放(或吸收)的能量。已知白磷和P4O6的分子結構如圖所示,現提供以下化學鍵的鍵能:E(P-P)=198kJ·mol-1、E(P-O)=360kJ·mol-1、E(O=O)=498kJ·mol-1,則反應P4(白磷)燃燒生成P4O6的熱化學方程式為:___________________。
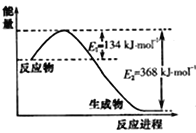
(3)如圖是1molNO2(g)和1molCO(g)反應生成CO2(g)和NO(g)過程中的能量變化示意圖,請寫出NO2和 CO反應的熱化學方程式: 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com