
【題目】反應Fe(s)+CO2(g)FeO(s)+CO(g),700℃時平衡常數為1.47,900℃時平衡常數為2.15.下列說法正確的是( )
A.升高溫度該反應的正反應速率增大,逆反應速率減小
B.該反應的化學平衡常數表達式為K= ![]()
C.該反應的正反應是吸熱反應
D.增大CO2濃度,平衡常數增大
【答案】C
【解析】解:A.升溫,正、逆反應速率均增大,故A錯誤;B.固體濃度視為常數,不列入平衡常數的表達式,故該化學平衡常數表達式為 ![]() ,故B錯誤;
,故B錯誤;
C.升溫,平衡常數增大,表明平衡向正反應方向移動,即正反應為吸熱反應,故C正確;
D.平衡常數只與溫度有關,與濃度無關;故增大反應物濃度,平衡常數不變,故D錯誤.
故選C.
【考點精析】解答此題的關鍵在于理解化學平衡狀態本質及特征的相關知識,掌握化學平衡狀態的特征:“等”即 V正=V逆>0;“動”即是動態平衡,平衡時反應仍在進行;“定”即反應混合物中各組分百分含量不變;“變”即條件改變,平衡被打破,并在新的條件下建立新的化學平衡;與途徑無關,外界條件不變,可逆反應無論是從正反應開始,還是從逆反應開始,都可建立同一平衡狀態(等效).


科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A.氧化還原反應的實質是電子的轉移
B.置換反應不一定是氧化還原反應
C.氧化劑發生氧化反應
D.有單質參加或者生成的反應一定屬于氧化還原反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】六種短周期元素a、b、c、d、e、f其原子序數與其最高正價或最低負價的關系如下圖所示。

(1)上述六種元素,其中屬于金屬元素的有________種。
(2)元素f在周期表中的位置是____________。
(3)由a、b、c三種元素組成既含離子鍵又含共價鍵的化合物,該化合物的化學式為________,該化合物的水溶液顯_________性,該化合物在水中的電離方程式為____________。
(4)b元素的氣態氫化物與f元素的氣態氫化物熔沸點高低順序為_________(用氫化物的化學式表示)。
(5)a與b、c兩元素分別可形成18電子的分子M和N,其中M的電子式為_______。化合物M是一種環保的液體燃料,常溫下8g液態M與足量的液態N反應可放出204.5kJ的熱量,則該反應的熱化學反應方程式為___________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列熱化學方程式表達正確的是(![]() 的絕對值均正確)
的絕對值均正確)
A. C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(g) △H=–1367.0 kJ/mol(燃燒熱)
B. NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1) △H= +57.3kJ/mol(中和熱)
C. S(s)+O2(g)=SO2(g) △H=–269.8kJ/mol (反應熱)
D. 2NO2=O2+2NO △H= +116.2kJ/mol (反應熱)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2A(g)+B(g)3C(g)+4D(g)的反應,在不同條件下的反應的速率最快的是( )
A.v(A)=0.7molL﹣1min﹣1
B.v (B)=0.3molL﹣1min﹣1
C.v (C)=0.9molL﹣1min﹣1
D.v (D)=0.8molL﹣1s﹣1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有Al、C12、Al2O3、HCl(aq)、Al(OH)3、NaOH(aq)六種物質,它們之間有如圖所示轉化關系,圖中每條線兩端的物質之間都可以發生反應,下列推斷不合理的是( )
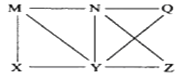
A. N一定是HCl(aq) B. X可能為Al或C12
C. Y一定為NaOH(aq) D. Q、Z中的一種必定為Al2O3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫酸亞鐵銨(NH4)aFeb(SO4)cdH2O又稱莫爾鹽,是淺綠色晶體。用硫鐵礦(主要含FeS2、SiO2等)制備莫爾鹽的流程如下:

已知:“還原”時,FeS2與H2SO4不反應,Fe3+通過反應Ⅰ、Ⅱ被還原,反應Ⅰ如下:FeS2 + 14Fe3+ + 8H2O =15Fe2+ + 2SO42— + 16H+
(1)寫出“還原”時Fe3+與FeS2發生還原反應Ⅱ的離子方程式:______。實驗室檢驗“還原”已完全的方法是_______________。
(2) “還原”前后溶液中部分離子的濃度見下表(溶液體積變化忽略不計):
離子 | 離子濃度(mol·L-1) | |
還原前 | 還原后 | |
SO42- | 3.20 | 3.40 |
Fe2+ | 0.05 | 2.15 |
請計算反應Ⅰ、Ⅱ中被還原的Fe3+的物質的量之比______。
(3)稱取11.76g新制莫爾鹽,溶于水配成250mL溶液。取25.00 mL該溶液加入足量的BaCl2溶液,得到白色沉淀1.398 g;另取25.00 mL該溶液用0.0200 mol/L KMnO4酸性溶液滴定,當MnO4-恰好完全被還原為Mn2+時,消耗溶液的體積為30.00mL。試確定莫爾鹽的化學式_________________(請寫出計算過程)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com