
【題目】為確認HCl、H2CO3、H2SiO3的酸性強弱,某學生設計了如圖所示的裝置,一次實驗即可達到目的(不必選其他酸性物質)。請據此回答:
①錐形瓶中裝某可溶性正鹽溶液,分液漏斗所盛試劑應為。
②裝置B所盛的試劑是 , 其作用是。
③裝置C所盛試劑是 ,
C中反應的離子方程式是。
④由此可得出的結論是:酸性>>。
【答案】鹽酸;飽和NaHCO3溶液;吸收HCl氣體;Na2SiO3溶液;SiO32-+CO2+H2O===H2SiO3↓+CO32-;HCl;H2CO3;H2SiO3
【解析】根據強酸+弱酸鹽―→弱酸+強酸鹽分析可知,分液漏斗中盛裝鹽酸,A中盛放Na2CO3 , 根據Na2CO3+2HCl===2NaCl+H2O+CO2↑可以知道酸性HCl強于H2CO3 , 然后將生成的CO2通入Na2SiO3溶液中,反應為Na2SiO3+CO2+H2O===H2SiO3↓+Na2CO3 , 由此判斷酸性H2CO3>H2SiO3 , 但需注意的是A中反應會有HCl氣體逸出,故通入Na2SiO3溶液前需將HCl吸收,但不能吸收CO2 , 故可選用飽和NaHCO3溶液。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】反應A(g)+B(g)→C(g)△H,分兩步進行:①A(g)+B(g)→X(g)△H1 , ②X(g)→C(g)△H2 , 反應過程中能量變化如圖所示,E1表示A(g)+B(g)→X(g)的活化能,下列說法正確的是( ) 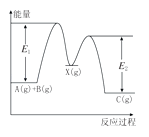
A.△H=E1﹣E2
B.E1是反應①的活化能
C.X是反應A(g)+B(g)→C(g)的催化劑
D.△H2>0
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述中正確的是 ( )
A. 摩爾是物質的質量的單位 B. 阿伏加德羅常數約為6.02×1023 mol-1
C. 碳的摩爾質量為12 g D. 氣體摩爾體積為22.4 L/mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國明代《本草綱目》沖收載藥物1892種,其中“燒酒”條目下寫道:“自元時始創其法,用濃酒和精人甑,蒸令氣上……其清如水,球極濃烈,蓋酒露也。”這里所用的“法”懸指
A. 萃取 B. 過濾 C. 蒸餾 D. 干餾
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將一定質量由鎂和鋁組成的合金投入200 mL一定物質的量濃度的鹽酸中,合金全部溶解,向所得溶液中滴加6 mol/L的NaOH溶液到過量,生成沉淀的質量與加入的NaOH溶液的體積關系如下圖所示:

下列說法不正確的是
A. 鎂鋁合金中,Mg與Al的物質的量之比為 2∶1
B. 所用鹽酸的物質的量濃度為4 mol/L
C. 圖像中的x=20
D. 圖像中,Ox 段的離子方程式為:H++OH-= H2O;y~150 段的離子方程式為:Al(OH)3+OH-=AlO2-+ 2H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列操作中,所使用的儀器能夠達到目的是( )
A.用5 mL量筒準確量取4.55 mL水
B.用托盤天平準確地稱取6.82 g食鹽
C.用廣泛pH試紙測得某鹽酸的pH為3.5
D.做KMnO4分解實驗時用大試管作反應器
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將下列四種鐵的化合物溶于稀鹽酸,滴加硫氰化鉀溶液沒有顏色變化,再加入氯水即呈紅色的是( )
A.FeS
B.Fe2O3
C.FeCl3
D.Fe2(SO)4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:將Cl2通人適量KOH溶液中,產物中可能有KCl、KClO、KClO3,且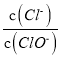 的值與溫度高低有關。當n(KOH)=amol時,下列有關說法錯誤的是
的值與溫度高低有關。當n(KOH)=amol時,下列有關說法錯誤的是
A. 若某溫度下,反應后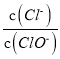 =3,則溶液中
=3,則溶液中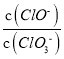 =5:2
=5:2
B. 參加反應的氯氣的物質的量等于0.5amol
C. 改變溫度,反應中轉移電子的物質的量ne-的范圍: ![]()
D. 改變溫度,產物中KCl的最大理論產量為![]() mol
mol
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com