
【題目】某工廠的工業廢水中含有大量的“FeSO4”、較多的Cu2+和少量的Na+。為了減少污染變廢為寶,工廠計劃從該廢水中回收硫酸亞鐵和銅。根據流程圖,完成回收硫酸亞鐵和銅的簡單實驗方案。回答下列問題:

(1)加入原料①為____________;操作②的名稱為___________,該操作所用到的玻璃儀器主要有______。
(2)固體A為____________;
(3)寫出加入原料①和②有關反應的離子方程式__________________、________________________。
(4)操作③獲得FeSO4·7H2O,需要經過_____、_____、過濾等操作。
【答案】Fe(或鐵粉) 過濾 漏斗、玻璃棒、燒杯 Fe和Cu Fe+Cu2+=Fe2++Cu Fe+2H+=Fe2++H2↑ 蒸發濃縮 冷卻結晶
【解析】
工業廢水中含有大量的FeSO4、Cu2+和少量的Na+,從該廢水中回收硫酸亞鐵和銅,可用單質鐵置換出銅,則結合流程可知原料①為Fe,操作①為過濾,所得固體為鐵和銅,原料②為稀硫酸溶解金屬鐵,然后過濾得到銅和硫酸亞鐵溶液,將二次的濾液合并得到硫酸亞鐵溶液,然后通過操作③蒸發濃縮、冷卻結晶、過濾,可得到FeSO4![]() 7H2O,以此來解答。
7H2O,以此來解答。
(1)工業廢水中含有大量的FeSO4、Cu2+和少量的Na+,根據流程圖中可以知道,完成回收硫酸亞鐵和銅,先加過量鐵粉把銅置換出來,Fe+Cu2+=Fe2++Cu,過濾,廢水中剩下FeSO4和少量的Na+,鐵粉、銅中加H2SO4得到FeSO4,原料①的試劑為Fe,操作②為過濾,過濾所需要的儀器為漏斗、玻璃棒、燒杯,
故答案為:Fe;過濾;漏斗、玻璃棒、燒杯;
(2)根據以上分析固體A是Fe和Cu,
故答案為:Fe和Cu;
(3)加入Fe后發生的離子方程式為Fe+Cu2+=Fe2++Cu;加入H2SO4后發生的離子方程式Fe+2H+= Fe2++H2↑;
故答案為:Fe+Cu2+=Fe2++Cu;Fe+2H+= Fe2++H2↑。
(4)根據流程圖中可以知道,操作Ⅰ加鐵粉,Fe+Cu2+=Fe2++Cu,過濾,廢水E中剩下FeSO4和少量的Na+,加入C中的B為H2SO4,因為鐵粉、銅中加入適量稀硫酸,稀硫酸和鐵粉反應,生成硫酸亞鐵,分離不溶于水的固體和液體,用過濾,回收硫酸亞鐵,需采用蒸發濃縮、冷卻結晶、過濾等操作,
故答案為:蒸發濃縮 ;冷卻結晶。


科目:高中化學 來源: 題型:
【題目】用無水 Na2SO3固體配制 250 mL 0.1000 mol·L-1 溶液的步驟如下圖,請回答:
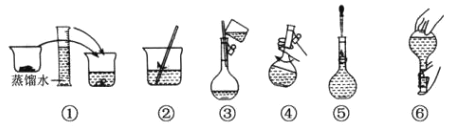
(1)在配制過程中必要的儀器有:燒杯、玻璃棒、膠頭滴管、 250ml 容量瓶和____________;檢驗容量瓶是否漏水的操作方法是____________________________________。
(2)下列操作不會對所配的Na2SO3溶液濃度產生誤差的是__________。
A.容量瓶剛用蒸餾水洗凈,沒有烘干
B.圖③沒有用蒸餾水洗燒杯 2-3 次,并轉移洗液
C.圖⑤時仰視容量瓶的刻度線
D.圖⑥后,發現液面略低于刻度線,再滴加少量水使液面凹面與刻度線相切
(3)已知亞硫酸鈉在空氣中能被氧氣氧化生成硫酸鈉,請設計實驗檢驗配制的 Na2SO3 溶液是否發生變質_______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知H2O2在催化劑作用下分解速率加快,其能量隨反應進程的變化如下圖所示。下列說法正確的是( )
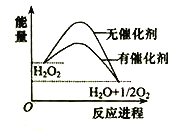
A. 加入催化劑,減小了反應的熱效應
B. 加入催化劑,可提高H2O2的平衡轉化率
C. H2O2分解的熱化學方程式:H2O2 → H2O + O2 + Q
D. 反應物的總能量高于生成物的總能量
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有73gHCl氣體,計算:
(1)該氣體為___ mol。
(2)該氣體所含分子數為_________個。
(3)該氣體在標準狀況下的體積為___ L。
(4)將該氣體溶于水配成2L溶液,其物質的量濃度為_______mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】合成氨及其相關工業中,部分物質間的轉化關系如下:

下列說法不正確的是( )
A. 反應Ⅰ、Ⅱ、Ⅲ、Ⅳ均屬于氧化還原反應
B. 上述轉化中包含了氨氣、硝酸、硝銨、小蘇打、純堿的工業生產方法
C. 反應Ⅳ和Ⅵ中的部分產物可在上述流程中循環利用
D. 反應V是先向飽和氯化鈉溶液中通CO2至飽和再通NH3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】炒過菜的鐵鍋未及時洗凈(殘液中含NaCl),不久便會因被腐蝕而出現紅褐色銹斑。腐蝕原理如右圖所示,下列說法正確的是

A. 腐蝕過程中,負極是C
B. Fe失去電子經電解質溶液轉移給C
C. 正極的電極反應式為4OH―-4e-==2H2O+O2↑
D. 每生成1mol鐵銹(Fe2O3·xH2O)理論上消耗標準狀況下的O233.6L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】[化學-選修5:有機化學基礎]
親水型功能高分子M和香料N可由如圖所示途徑合成(部分產物略去):

已知:
①A是芳香烴的含氧衍生物,相對分子質量為108
②有機物分子中,同一個碳原子上連接有兩個羥基時不穩定,會自動脫水
(S)R1CHO + R2CH2CHO![]() R1CH=
R1CH=![]() +H2O
+H2O
請回答下列問題:
(1)E的化學名稱_______,C的結構簡式 _______;
(2) M中的含氧官能團的名稱為_______,A生成B的反應類型________;
(3)寫出F到G的第一步化學方程式______________;
(4)同時滿足下列條件的G的同分異構體有____種(不考慮立體異構,不計G本身)
①苯環上有四種不同的氫
②能與NaHCO3溶液反應產生氣體
③遇氯化鐵溶液會顯色
④分子中只存在一個環
(5)仿照題中的合成線路圖,以乙醇為起始物,無機試劑任選,寫出合成聚-2-丁烯醛的線路圖:________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數的值,下列敘述錯誤的是

A.含16 g氧原子的二氧化硅晶體中含有的δ鍵數目為2NA
B.23.4 g NaCl晶體中含有0.1NA個如圖所示的結構單元
C.常溫常壓下,5 g D2O含有的質子數、電子數、中子數均為2.5NA
D.2 mol SO2和1 mol O2在一定條件下反應所得混合氣體分子數小于2NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將少量飽和FeCl3溶液分別滴加到下列物質中,得到三種分散系,完成相關問題:
甲:飽和FeCl3溶液滴加到冷水中;
乙:飽和FeCl3溶液滴加到NaOH溶液中;
丙:飽和FeCl3溶液滴加到沸水中。
(1)將丙繼續加熱煮沸得到紅褐色透明液體,反應的化學方程式為____________________。
(2)用最簡單的方法判斷丙中是否成功制備膠體,請寫出相關的操作、現象和結論____________________________________________________________。
(3)向經過檢驗后的丙中逐滴加入稀鹽酸,會出現一系列變化:
①先出現和乙中相同的現象,原因為________________________。
②隨后發生變化得到和甲相同的溶液,此反應的離子反應方程式為____________________。
(4)向丙中加入電極通電后,Fe(OH)3膠體粒子移向_______極;(填“陰極”或“陽極”)
(5)可用如圖所示的裝置除去Fe(OH)3膠體中的雜質離子來提純Fe(OH)3膠體,實驗過程中需不斷更換燒杯中的蒸餾水。更換蒸餾水若干次后,取少量燒杯中的液體,向其中加入AgNO3溶液,若____________________(填實驗現象),則說明該Fe(OH)3膠體中的雜質離子已經完全除去。
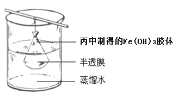
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com