
【題目】以下實驗或操作不能達到目的的是( )
A.用溴水鑒別苯、乙醇、四氯化碳
B.用氫氧化銅粉末檢驗尿糖
C.用石蕊試液檢驗乙酸和乙醇
D.用激光筆檢驗淀粉溶液的丁達爾現象
 期末寶典單元檢測分類復習卷系列答案
期末寶典單元檢測分類復習卷系列答案科目:高中化學 來源: 題型:
【題目】用一種陰、陽離子雙隔膜三室電解槽處理廢水中的NH4+ , 模擬裝置如圖所示,下列說法正確的是( ) 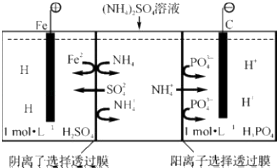
A.陽極室溶液由無色變成棕黃色
B.陰極的電極反應式為:4OH﹣﹣4e═2H2O+O2↑
C.電解一段時間后,陰極室溶液中的pH升高
D.電解一段時間后,陰極室溶液中的溶質一定是(NH4)3PO4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】苯乙酸銅是合成優良催化劑、傳感材料﹣﹣納米氧化銅的重要前驅體之一,下面是它的一種實驗室合成路線: 
制備苯乙酸的裝置示意圖如圖(加熱和夾持裝置等略):
已知:苯乙酸的熔點為76.5℃,微溶于冷水,溶于乙醇.
回答下列問題:
(1)在250mL三口瓶a中加入70mL 70%硫酸,配制此硫酸時,加入蒸餾水與濃硫酸的先后順序是;
(2)將a中的溶液加熱至100℃,緩緩滴加40g苯乙腈到硫酸溶液中,然后升溫至130℃繼續反應.在裝置中,儀器b的作用是;儀器c的名稱是 , 其作用是 , 反應結束后加適量冷水,再分離出苯乙酸粗品.加入冷水的目的是 , 下列儀器中可用于分離苯乙酸粗品的是(填標號) A、分液漏斗 B、漏斗 C、燒杯 D、直形冷凝管 E、玻璃棒
(3)提純苯乙酸的方法是 , 最終得到44g純品,則苯乙酸的產率是;
(4)用CuCl22H2O和NaOH溶液制備適量Cu(OH)2沉淀,并多次用蒸餾水洗滌沉淀,判斷沉淀洗干凈的實驗操作和現象是;
(5)將苯乙酸加入到乙醇與水的混合溶劑中,充分溶解后,加入Cu(OH)2攪拌30min,過濾,濾液靜置一段時間,析出苯乙酸銅晶體,混合溶劑中乙醇的作用是 . 
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對于相同物質的量的SO2與SO3,下列說法正確的是( )
A.硫元素的質量比為5:4 B.原子總數之比為4:3
C.質量之比為1:1 D.分子數之比為1:1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】天然氣是一種重要的清潔能源和化工原料,其主要成分為甲烷.
(1)已知:CO(g)+H2O(g)H2(g)+CO2(g)△H=﹣41kJmol﹣1C(s)+2H2(g)CH4(g)△H=﹣73kJmol﹣1
2CO(g)C(s)+CO2(g)△H=﹣171kJmol﹣1
工業上可用煤制天然氣,生產過程中有多種途徑生成CH4 . 寫出CO與H2反應生成CH4和H2O的熱化學方程式 .
(2)天然氣中的H2S雜質常用氨水吸收,產物為NH4HS.一定條件下向NH4HS溶液中通入空氣,得到單質硫并使吸收液再生,寫出再生反應的化學方程式 .
(3)用天然氣制取H2的原理為:CO2(g)+CH4(g)2CO(g)+2H2(g).在密閉容器中通入物質的量濃度均為0.1molL﹣1的CH4與CO2 , 在一定條件下發生反應,測得CH4的平衡轉化率與溫度及壓強的關系如下圖1所示,則壓強P1P2(填“大于”或“小于”);壓強為P2時,在Y點:v(正)v(逆)(填“大于”、“小于”或“等于”).求Y點對應溫度下的該反應的平衡常數K= . (計算結果保留兩位有效數字)
(4)以二氧化鈦表面覆蓋CuAl2O4 為催化劑,可以將CH4和CO2直接轉化成乙酸.①在不同溫度下催化劑的催化效率與乙酸的生成速率如圖2所示.250~300℃時,溫度升高而乙酸的生成速率降低的原因是 .
②為了提高該反應中CH4的轉化率,可以采取的措施是 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關0.1mol/LNa2S溶液的敘述正確的是( )
A.該溶液中存在兩個平衡、七種粒子
B.該溶液中K+、NH ![]() 、NO
、NO ![]() 、Al3+可以大量共存
、Al3+可以大量共存
C.滴加少量稀硫酸,充分振蕩無現象
D.通入足量SO2氣體,發生反應的離子方程式:2S2﹣+SO2+2H2O═3S↓+4OH﹣
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】離子推斷題:有一未知的無色溶液,可能含有以下離子中的若干種(忽略由水電離產生的H+、OH-):H+、NH4+、K+、Mg2+、Fe3+、Al3+,NO3-、CO32-、SO42-,現取兩份100mL溶液進行如下實驗:
①第一份加入足量的BaCl2溶液后,有白色沉淀產生,經洗滌、干燥后,稱量沉淀質量為6.99g;
②第二份逐滴滴加NaOH溶液,測得沉淀的物質的量與NaOH溶液的體積關系如下圖所示。
根據上述實驗事實,回答以下問題:
⑴該溶液中一定不存在的陽離子有 ;
⑵在實驗②中,NaOH溶液滴至b~c段過程中發生的離子反應方程式為 ;NaOH溶液的濃度為 (用含字母c、d的代數式表示);
⑶確定原溶液一定含有Mg2+、Al3+、H+,其物質的量之比n(Mg2+): n(Al3+):n(H+)為 (填數字,下同);
⑷原溶液中NO3-的濃度為c(NO3-),則c(NO3-)的取值范圍為 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:X、Y分別是地殼中含量最高的金屬和非金屬元素的單質,D、E、F為氣體,X在酸性或堿性溶液中均可與NO3-發生氧化還原反應,氣體D和G反應可生成鹽,氣體D和A溶液反應生成白色沉淀,氣體E和F在NaOH溶液中按1:1反應鈉鹽M,各物質轉化關系如下:

請回答下列問題:
(1)M的化學式__________。
(2)請寫出D的溶液與A溶液反應的離子方程式:___________
(3)寫出X在堿性條件下與NO3-反應的離子方程式:_____________
(4)標況下,若E,F的混合氣體共48mL,恰好被10mL菜濃度的NaOH溶液吸收,則該NaOH溶液濃度為______mol,若反應后所得溶液中M和N的濃度之比為7:1,則原來氣體中E與F的體積比為________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com