
【題目】常溫下,向10mL0.1mol·L-1的HR溶液中逐漸滴入0.1mol·L-1的NH3·H2O溶液,所得溶液pH及導電能力變化如圖。下列分析不正確的是

A. a~b點導電能力增強,說明HR為弱酸
B. b點溶液pH=7,此時酸堿恰好中和
C. b、c兩點水的電離程度:b<c
D. c點溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+)
【答案】C
【解析】A、加入10mL等濃度的氨水,兩者恰好完全反應,HR+NH3·H2O=NH4R+H2O,假設HR為強酸,NH4R是強電解質,反應前后導電能力相同,但a~b圖像導電能力增大,因此假設錯誤,即HR為弱酸,故說法正確;B、根據圖像,加入10mLNH3·H2O,此時pH=7,b點導電能力最強,說明此時兩者恰好完全反應,故說法正確;C、b點溶質為NH4R,NH4R是弱酸弱堿,發生水解,促進水的電離,c點溶質NH4R、NH3·H2O,此時溶液顯堿性,說明NH3·H2O的電離程度大,NH3·H2O是弱堿,對水的電離抑制作用,兩點水的電離程度為b>c,故說法錯誤;D、c點溶質NH4R、NH3·H2O,此時溶液顯堿性,說明NH3·H2O的電離程度大,因此c(NH4+)>c(R-),c(OH-)>c(H+),故說法正確。


科目:高中化學 來源: 題型:
【題目】①甲烷、②乙烷、③乙烯、④苯、⑤甲苯、⑥二甲苯、⑦乙醇、⑧乙酸、
⑨葡萄糖,它們都是常見的重要化工原料。
(1)上述物質中,氫元素的質量分數最大的是________(填分子式),等質量的物質完全燃燒耗氧量相同的是_____________________(填分子式)。
(2)上述物質中,能發生加成反應的烴類物質有:_______________(填序號)。
(3)甲烷和苯都可以發生取代反應,反應條件分別是___________、___________。
(4)聚氯乙烯,簡稱PVC,這種材料如果用于食品包裝,它對人體的安全性有一定的影響,PVC由Cl—CH=CH2在一定條件下聚合而成,寫出該反應的化學方程式:____________。
(5)苯、甲苯、二甲苯是用途廣泛的有機溶劑。二甲苯的結構有______種,其中一種被稱為“PX”,它的一氯代物只有兩種,則“PX”的結構簡式是______________。
(6)寫出乙醇催化氧化的化學方程式 _________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲同學進行了FeCl2溶液的配制、濃度的測定以及Fe2+還原性的實驗,并針對異常現象進行探究。
步驟一:制取FeCl2甲同學準備用兩種方案制取。
方案1:按下圖裝置用H2還原無水FeCl3制取。
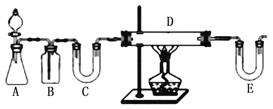
E中盛放的試劑是____________;D中反應的化學方程式為____________。此方案有個明顯的缺陷是___________________________。
方案2:由0.1 molL-1 FeCl3溶液制取FeCl2溶液,你認為其操作應該是____________ 。
步驟二:測定方案2所配FeCl2溶液的物質的量濃度。用重鉻酸鉀法(一種氧化還原滴定法)可達到目的。若需配制濃度為0.01000 mol·L-1的K2Cr2O7標準溶液480 mL,實驗中用到的玻璃儀器有量筒、玻璃棒、燒杯,還缺少_______________,
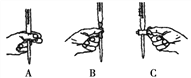
本實驗滴定過程中操作滴定管的圖示正確的是____________(填編號)。
下列錯誤的操作使測定的FeCl2 溶液濃度偏小的是______________。
A.若在配制K2Cr2O7標準溶液定容時采取俯視姿勢
B.若滴定操作中,如果滴定前裝有K2Cr2O7標準溶液的滴定管尖嘴部分有氣泡,而滴定結束后氣泡消失。
C.錐形瓶洗凈后未干燥
步驟三:向2 mL FeCl2溶液中滴加2滴0.1 mol·L-1 KSCN溶液,無現象;再滴加5滴5% H2O2溶液(物質的量濃度約為1.5 mol·L-1、pH約為5),觀察到溶液變紅,大約10秒左右紅色褪去,有氣體生成(經檢驗為O2)。
甲同學探究“步驟三”中溶液褪色的原因:
實驗I.取褪色后溶液兩份,一份滴加FeCl3溶液無現象;另一份滴加KSCN溶液出現紅色;
實驗II.取褪色后溶液,滴加鹽酸和BaCl2溶液,產生白色沉淀,并測得生成了兩種可直接排放到空氣中的氣體。
實驗III.向2 mL 0.1 mol·L-1 FeCl3溶液中滴加2滴0.1 molL-1 KSCN溶液,變紅,通入O2,無明顯變化。
①實驗I說明溶液紅色褪去是因為SCN-發生了反應而不是Fe3+發生反應。
②實驗III的目的是_____________________。
得出結論:溶液褪色的原因是酸性條件下H2O2將SCN-氧化成SO42-和相關氣體。寫出該反應的離子方程式_______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Na2CO3俗名純堿,下面是對純堿采用不同的分類法進行分類,其中正確的是
A.Na2CO3是堿 B.Na2CO3是鹽
C.Na2CO3是鈉鹽 D.Na2CO3是碳酸鹽
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】亞硫酸鹽在工業生產中冇廣泛的應用,某同學在實驗中對亞硫酸鹽的制備和性質進行探究。
(1)Cu2SO3·CuSO32H2O是一種深紅色固體,不溶于水和乙醇,100℃時發生分解,其制備實驗裝置如圖所示。

①儀器X的名稱是________。常溫下用裝置A制取SO2時,用較濃的硫酸而不用稀硫酸,其原因是____________________。
②裝置C的作用是________________________。
③裝置B中發生反應的離子方程式為_____________________。
④從裝置B中獲得的固體需先用蒸餾水充分洗滌,再真空干燥,而不直接用烘干的方式得到產品,其原因是_________________________。
(2)向NaHSO3溶液中加入NaClO溶液時,反應有三種可能的情況:
I.NaHSO3和NaClO恰好反應;II.NaHSO3過量;III.NaClO過量。甲同學欲通過下列實驗確定該反應屬于哪一種情況,請完成下表:
實驗操作 | 預期現象及結論 |
取上述反應后的混合溶液于試管 A中,滴加稀硫酸 | 若有氣泡產生,則_①__(填“I”“II”或“III”,下同)成立,若沒有氣泡產生,則_②___成立 |
另取上述反應后的混合溶液于試管B中,滴加幾滴淀粉KI溶液, 充分振蕩 | ③___,則III成立 |
(3)請設計簡單實驗方案比較室溫下NaHSO3濃液中HSO3-的電離平衡常數Ka與水解平衡常數Kb的相對大小:________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某固體混合物可能由SiO2、Fe2O3、Fe、Na2SO3、Na2CO3、BaCl2中的兩種或兩種以上的物質組成。某興趣小組為探究該固體混合物的組成,設計的部分實驗方案如下圖所示:
下列說法正確的是

A. 氣體A是SO2和CO2的混合氣體
B. 固體A一定含有SiO2,可能含有BaSO4
C. 該固體混合物中Fe2O3和Fe至少有其中一種
D. 該固體混合物一定含有Fe、Na2SO3、BaCl2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)有①![]() 、
、![]() 、
、![]() ②H2、D2、T2 ③石墨、金剛石 ④
②H2、D2、T2 ③石墨、金剛石 ④![]() 、
、![]() 、
、![]() 四組微粒或物質。互為同位素的是__________________(填編號)。
四組微粒或物質。互為同位素的是__________________(填編號)。
(2)下列物質中:①N2 ②MgCl2 ③NH4Cl ④CH4 ⑤CO2 ⑥Ne ⑦H2S ⑧KOH ⑨Na2O2 ⑩K2O 只存在共價鍵的是___________;屬于離子化合物,但含有共價鍵的是______。
(3) 用電子式表示下列物質:
MgCl2___________N2___________NH4+___________Na2O2___________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】醋酸在水中電離方程式可表示為:CH3COOH![]() CH3COO—+H+ ΔH>0,下列操作能使H+ 濃度增大的是 ( )
CH3COO—+H+ ΔH>0,下列操作能使H+ 濃度增大的是 ( )
A. 加入少量NaOH固體 B. 小心加熱升溫10oC C. 加入鋅粉 D. 加入固體CH3COONa
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com