
常溫下,下列有關醋酸溶液的敘述中不正確的是( )
| A.pH=5.6的CH3COOH與CH3COONa混合溶液中:c(Na+)<c(CH3COO-) |
| B.濃度均為0.1 mol·L-1的CH3COOH和CH3COONa溶液等體積混合后:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
| C.將pH=a的醋酸稀釋為pH=a+1的過程中,c(CH3COOH)/c(H+)減小 |
| D.等體積pH=a的醋酸與pH=b的NaOH溶液恰好中和時,a+b=14 |
科目:高中化學 來源: 題型:單選題
某溫度下,體積和pH都相同的鹽酸和氯化銨溶液加水稀釋時的pH變化曲線如圖所示,下列判斷正確的是
| A.a、c兩點溶液的導電能力相同 |
| B.b點溶液中c(H+)+c(NH3·H2O)=c(OH-) |
| C.a、b、c三點溶液中水的電離程度a>b>c |
| D.用等濃度NaOH溶液和等體積b、c處溶液反應,消耗NaOH溶液體積Vb=Vc |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
對“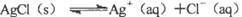 ”的理解正確的是( )。
”的理解正確的是( )。
| A.說明AgCl沒有完全電離,AgCl是弱電解質 |
| B.說明溶解的AgCl已完全電離,AgCl是強電解質 |
| C.說明Ag+與Cl-的反應不能完全進行到底 |
| D.說明Ag+與Cl-的反應可以完全進行到底 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
在pH都等于9的NaOH和CH3COONa兩種溶液中,設由水電離產生的OH-離子濃度分別為A mol·L-1與B mol·L-1,則A和B的關系為
| A.A>B | B.A=10-4B | C.B=10-4A | D.A=B |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
常溫下,下列溶液中有關物質的量濃度關系和計算不正確的是
A.c(NH4+)相等的(NH4)2SO4、(NH4)2Fe(SO4)2和NH4Cl溶液中,溶質濃度大小關系是:c(NH4Cl)<c[(NH4)2SO4]<c[(NH4)2Fe(SO4)2]
B.已知25℃時Ksp(AgCl)=1.8×10-10,則在0.1mol·L-1AlCl3溶液中,Ag+的物質的量濃度最大可達到6.0×10-10mol·L-1
C.0.2mol·L-1 HCl溶液與等體積0.05 mol·L-1 Ba(OH)2溶液混合后,溶液的pH="1"
D.室溫下,0.1mol?L-1NaHA溶液的pH=4,則有c(HA-)>c(H+)>c(A2-)>c(H2A)
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
室溫下,將一元酸HA的溶液和KOH溶液等體積混合(忽略體積變化),實驗數據如下表:
| 實驗編號 | 起始濃度/(mol·L-1) | 反應后溶液的pH | |
| c(HA) | c(KOH) | ||
| ① | 0.1 | 0.1 | 9 |
| ② | x | 0.2 | 7 |
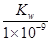 mol/L
mol/L查看答案和解析>>
科目:高中化學 來源: 題型:單選題
25℃時,濃度均為1 mol/L的AX、BX、AY、BY四種正鹽溶液,AX溶液的pH=7且溶液中c(X-)=1 mol/L,BX溶液的pH=4,BY溶液的pH=6。下列說法正確的是( )
| A.AY溶液的pH小于7 |
| B.AY溶液的pH小于BY溶液的pH |
| C.稀釋相同倍數,BX溶液的pH變化小于BY溶液 |
| D.電離平衡常數K(BOH)小于K(HY) |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
已知0.1 mol·L-1的醋酸溶液中存在電離平衡:CH3COOH CH3COO-+H+。欲使平衡發生如圖變化,可以采取的措施是( )
CH3COO-+H+。欲使平衡發生如圖變化,可以采取的措施是( )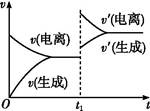
| A.加少量燒堿溶液 | B.升高溫度 | C.加少量冰醋酸 | D.加水 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16。下列關于難溶物之間轉化的說法中錯誤的是( )
| A.AgCl不溶于水,不能轉化為AgI |
| B.兩種難溶物的Ksp相差越大,難溶物就越容易轉化為更難溶的物質 |
| C.AgI比AgCl更難溶于水,所以AgCl可以轉化為AgI |
D.常溫下,AgCl若要在NaI溶液中開始轉化為AgI,則NaI的濃度必須不低于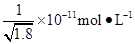 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com