
【題目】下列有關細胞中元素和化合物的敘述,正確的是( )
A. Mg雖然是微量元素但在光合作用中起很重要的作用,不可缺少
B. 脂肪分子中含氫比糖類多,是主要的能源物質
C. 氨基酸脫水縮合產生水,水中的氧來自氨基酸的羧基
D. RNA和DNA主要組成元素的種類不同,堿基種類不完全相同
科目:高中化學 來源: 題型:
【題目】已知圖一表示的是可逆反應CO(g)+H2(g)![]() C(s)+H2O(g) ΔH>0的化學反應速率(v)與時間(t)的關系,圖二表示的是可逆反應2NO2(g)
C(s)+H2O(g) ΔH>0的化學反應速率(v)與時間(t)的關系,圖二表示的是可逆反應2NO2(g)![]() N2O4(g) ΔH<0的濃度(c)隨時間t的變化情況。下列說法中正確的是( )
N2O4(g) ΔH<0的濃度(c)隨時間t的變化情況。下列說法中正確的是( )

A. 圖一t2時改變的條件可能是升高了溫度或增大了壓強
B. 若圖一t2時改變的條件是增大壓強,則反應的ΔH增大
C. 圖二t1時改變的條件可能是升高了溫度或增大了壓強
D. 若圖二t1時改變的條件是增大壓強,則混合氣體的平均相對分子質量將減小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氨氣常用作致冷劑及制取銨鹽和氮肥,是一種用途廣泛的化工原料。
(1)下圖是當反應器中按按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下,反應達到平衡時,混合物中NH3的物質的量分數隨壓強的變化曲線。

①曲線a對應的溫度是 。
②關于工業合成氨的反應,下列敘述正確的是 (填字母)。
A.及時分離出NH3可以提高H2的平衡轉化率
B.加催化劑能加快反應速率且提高H2的平衡轉化率
C.上圖中M、N、Q點平衡常數K的大小關系是K(M)= K(Q) >K(N)
③ M點對應的H2轉化率是 。
(2)工業制硫酸的尾氣中含較多的SO2,為防止污染空氣,回收利用SO2,工業上常用氨水吸收法處理尾氣。當氨水中所含氨的物質的量為3 mol ,吸收標準狀況下44.8 L SO2時,溶液中的溶質為 。
(3)氨氣是一種富氫燃料,可以直接用于燃料電池,下圖是供氨水式燃料電池工作原理:

①氨氣燃料電池的電解質溶液最好選擇 (填“酸性”、“堿性”或“中性”)溶液。
②空氣在進入電池裝置前需要通過過濾器除去的氣體是 。
③氨氣燃料電池的反應是氨氣與氧氣生成一種常見的無毒氣體和水,該電池正極的電極反應方程式是 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學反應中的能量變化是由化學反應中舊化學鍵斷裂時吸收的能量與新化學鍵形成時放出的能量不同引起的。如圖為N2(s)和q (s)反應生成NO(g)過程中的能量變化,下列說法中正確的是

A.1mol N2(g)和1mol O2(g)反應放出的能量為180kJ
B.1mol N2(g)和1mol O2(g)具有的總能量小于2mol NO(g)具有的總能量
C.在1L的容器中發生反應,10min內N2減少了1mol,因此10min內的平均反應速率v(NO)=0.1mol/(L·min)
D.NO是一種酸性氧化物,能與NaOH溶液反應生成鹽和水
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】無色氣體N2O4是一種強氧化劑,為重要的火箭推進劑之一。N2O4與NO2轉換的熱化學方程式為:N2O4(g) ![]() 2 NO2(g) △H=+24.4 kJ/mol
2 NO2(g) △H=+24.4 kJ/mol
(1)將一定量N2O4投入固定容積的真空容器中,下述現象能說明反應達到平衡的是_________________。
a.v正(N2O4)=2 v逆(NO2) b.體系顏色不變
c.氣體平均相對分子質量不變 d.氣體密度不變
達到平衡后,保持體積不變升高溫度,再次到達平衡時,則混合氣體顏色________(填 “變深”、“變淺”或“不變”)。
(2)平衡常數K可用反應體系中氣體物質分壓表示,即K表達式中用平衡分壓代替平衡濃度,分壓=總壓×物質的量分數(例如:p(NO2)=p總·x(NO2)。寫出上述反應平衡常數Kp表達式________________(用p總、各氣體物質的量分數x表示);影響Kp的因素是____________________。
(3)上述反應中,正反應速率v正=k正·p(N2O4),逆反應速率v逆=k逆·p 2(NO2),其中k正、k逆為速率常數,則Kp為_________(以k正、k逆表示)。若將一定量N2O4投入真空容器中恒溫恒壓分解(溫度298 K、壓強100 kPa),已知該條件下k正=4.8×l04 s-1 ,當N2O4分解10%時,v正=___________kPa·s-1。
(4)真空密閉容器中放入一定量N2O4,維持總壓強p0恒定,在溫度為T時,平衡時N2O4分解百分率為a。保持溫度不變,向密閉容器中充入等量N2O4,維持總壓強在2p0條件下分解,則N2O4的平衡分解率的表達式為_______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關實驗的操作、原理和現象的敘述正確的是
A.在4mL0.1mol·L-1的K2Cr2O7溶液中滴加數滴1mol·L-1的NaOH溶液,溶液顏色從橙色變成黃色
B.配制0.1 mol/L的H2SO4溶液時,將量取的濃H2SO4放入容量瓶中加水稀釋
C.用干燥且潔凈的玻璃棒蘸取NaClO溶液,滴到放在表面皿上的pH試紙上測pH值
D.在用簡易量熱計測定反應熱時,可使用碎泡沫起隔熱保溫的作用,迅速混合后測出初始溫度,用環形玻璃攪拌棒進行攪拌使酸和堿充分反應、準確讀取實驗時溫度計最高溫度、并且取2-3 次的實驗平均值等措施,以達到良好的實驗效果
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,向20mL的某稀H2S04溶液中滴入0.1mol/L氨水,溶液中水電離出氫離子濃度隨滴人氨水體積變化如圖。下列分析正確的是( )
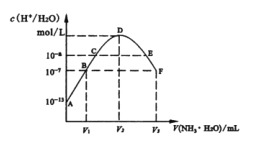
A.稀硫酸的濃度為0.1mol/L
B.C點溶液pH=14-a
C.E溶液中存在:c(NH4+)>c(SO42-)>c(H+)>c(OH-)
D.B到D、D到F所加氨水體積一定相等
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com