
【題目】碘在醫藥衛生、高純度金屬提煉、光學儀器等領域起著至關重要的作用。從含碘化鉀廢液(可能還含有I2、IO3-)中回收I2,實驗過程如下:
(1)確定碘的存在形式
①I2的確定:取含碘廢液放入試管,加入CCl4,振蕩靜置,現象為_____,確定含有I2。
②IO3-的確定:取①中上層溶液,加入少量新配制的0.1mo/LFeSO4溶液,它的作用是____。振蕩使之充分反應,再加入少量CCl4,CCl4層無紫色出現,說明該含碘廢液中無IO3-。
(2)碘的回收
在含碘廢液中加入適量的K2Cr2O7溶液和稀H2SO4,充分反應后經減壓過濾得到粗碘,由粗碘提純精制碘的裝置如圖:
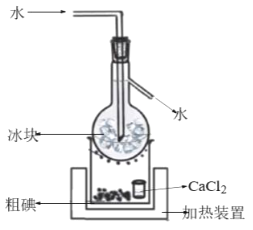
①補全得到粗碘的離子方程式:______。
□Cr2O72-+□I-+□ =□ +□Cr3++□ 。
②CaCl2的作用是__。
(3)碘的純度分析(已知:2S2O32-+I2=2I-+S4O62-)
精確量取0.1136g精制后的碘置于250mL碘量瓶中,加入0.5gKI和30mL水,振蕩至完全溶解(KI僅用于溶解)。以0.0513mol·L-1的Na2S2O3溶液快速滴定至淡黃色,加入1mL左右淀粉溶液,緩慢滴定至____,消耗Na2S2O3溶液17.26mL。碘的純度的計算表達式為____。
【答案】溶液分層,上層近于無色,下層紫色 還原IO3-生成I2 Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O 吸水劑 當滴入最后一滴Na2S2O3溶液,碘量瓶內溶液藍色消失,且半分鐘內不變色 ![]() ×100%
×100%
【解析】
⑴①取含碘廢液放入試管,加入CCl4,萃取分層,CCl4的密度水大;②利用FeSO4與IO3-反應生成單質碘和鐵離子。
⑵②CaCl2的作用是吸水劑。
⑶加入1mL左右淀粉溶液,緩慢滴定至當滴入最后一滴Na2S2O3溶液,碘量瓶內溶液藍色消失,且半分鐘內不變色,根據反應方程式2S2O32 + I2 = 2I- + S4O62得到單質碘的物質的量,再計算碘的純度。
⑴①取含碘廢液放入試管,加入CCl4,振蕩靜置,由于CCl4的密度水大,因此現象為溶液分層,上層近于無色,下層紫色,確定含有I2;故答案為:溶液分層,上層近于無色,下層紫色。
②取①中上層溶液,加入少量新配制的0.1 molL1 FeSO4溶液,利用FeSO4與IO3-反應生成單質碘和鐵離子,因此它的作用是還原IO3-生成I2;故答案為:還原IO3-生成I2。
⑵①得到粗碘的離子方程式:Cr2O72 + 6 I-+14 H+= 3 I2+ 2Cr3++ 7H2O;故答案為:Cr2O72 + 6 I-+14 H+= 3 I2+ 2Cr3++ 7H2O。
②CaCl2的作用是吸水劑;故答案為:吸水劑。
⑶以0.0513mol·L-1的Na2S2O3溶液快速滴定至淡黃色,加入1mL左右淀粉溶液,緩慢滴定至當滴入最后一滴Na2S2O3溶液,碘量瓶內溶液藍色消失,且半分鐘內不變色,消耗Na2S2O3溶液17.26mL。根據反應方程式2S2O32 + I2 = 2I- + S4O62得到單質碘的物質的量n(I2) = ![]() ×0.0513mol·L-1×0.01726L =
×0.0513mol·L-1×0.01726L = ![]() ×0.0513×0.01726 mol;因此碘的純度的計算表達式為
×0.0513×0.01726 mol;因此碘的純度的計算表達式為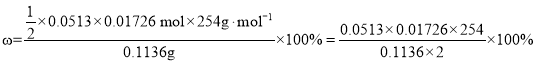 ;故答案為:當滴入最后一滴Na2S2O3溶液,碘量瓶內溶液藍色消失,且半分鐘內不變色;
;故答案為:當滴入最后一滴Na2S2O3溶液,碘量瓶內溶液藍色消失,且半分鐘內不變色;![]() 。
。


科目:高中化學 來源: 題型:
【題目】2019年諾貝爾化學獎授予美國科學家約翰古迪納夫、斯坦利惠廷厄姆和日本科學家吉野彰,以表彰他們在鋰離子電池研發領域作出的貢獻。近日,有化學家描繪出了一種使用DMSO(二甲基亞砜)作為電解液,并用多孔的黃金作為電極的鋰—空氣電池的實驗模型,該電池放電時在多孔的黃金上氧分子與鋰離子反應,形成過氧化鋰(Li2O2),其裝置圖如圖所示。下列有關敘述正確的是
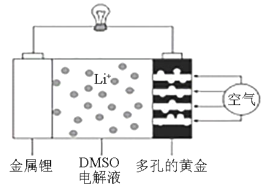
A.DMSO電解液能傳遞Li+和電子,不能換成水溶液
B.該電池放電時每消耗2molO2,轉移4mol電子
C.該池放電時,外電路中電流的方向為從金屬鋰電極流出
D.多孔的黃金為電池正極,電極反應式可能為O2+4e-=2O2-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】海水資源的利用具有廣闊的前景。從海水中提取Br2與MgCl26H2O的流程如圖:
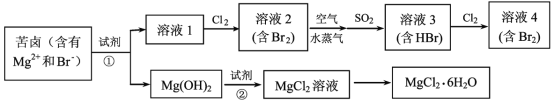
(1)海水淡化的方法有蒸餾法、___(任寫一種)等,考慮成本及效益試劑①可選用___。
(2)比較溶液中Br2的濃度:溶液2___溶液4(填“>”或“<”)。
(3)鼓入空氣與水蒸氣將Br2吹出,吹出的氣體用SO2吸收,其化學方程式是__。
(4)從MgCl2溶液獲得MgCl26H2O晶體的主要操作包括____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室為準確測定FeSO4的濃度,可用重鉻酸鉀標準溶液進行滴定。(已知重鉻酸鉀被還原為Cr3+)
步驟1.用分析天平準確稱取2.9400g重鉻酸鉀,配制500mL重鉻酸鉀標準溶液;
步驟2.移取25.00mL所配制的重鉻酸鉀標準溶液于500mL錐形瓶中,用蒸餾水稀釋至250mL,再加20mL濃硫酸,冷卻后,加2~3滴試亞鐵靈指示劑;
步驟3.用待測硫酸亞鐵溶液滴定至溶液由橙黃到綠,由綠色剛變為紅紫色為終點;
步驟4.記錄消耗硫酸亞鐵溶液的體積為18.70 mL。
(1)配制500mL重鉻酸鉀標準溶液需要的玻璃儀器有量筒、燒杯、 ____________________
(2)移取K2Cr2O7溶液選用的儀器是___________,盛裝待測硫酸亞鐵溶液選用的儀器是___________
A.50mL酸式滴定管 B.25mL堿式滴定管 C.25mL量筒
(3)氧元素位于周期表的______分區,鐵元素在周期表中的位置是___________________,Fe2+的簡化電子排布式為_________________,基態鉻原子的價電子電子排布圖為 __________________。
(4)測得FeSO4的濃度為 ______________ 。(小數點后保留兩位數字)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數的值。下列敘述不正確的是
A.28gN2所含分子數為NA
B.0.2 mol/L Na2SO4中所含Na+ 數為0.4NA
C.標準狀況下11.2L H2中所含原子數為NA
D.0.5mol CH4和1mol H2O中所含氫原子數均為2NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度下,在一容積可變的容器中,反應2A(g)+B(g)![]() 2C(g)達到平衡時,A、B和C的物質的量分別為4mol、2mol和4mol,保持溫度和壓強不變,對平衡混合物中三者的物質的量做如下調整,可使平衡右移的是( )
2C(g)達到平衡時,A、B和C的物質的量分別為4mol、2mol和4mol,保持溫度和壓強不變,對平衡混合物中三者的物質的量做如下調整,可使平衡右移的是( )
A. 均減半 B. 均加倍 C. 均增加1mol D. 均減少1mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定條件下,反應N2+3H2![]() 2NH3在10L恒容密閉容器中進行,測得2min內,H2的物質的量由20mol減少到8mol,則2min內NH3的化學反應速率為
2NH3在10L恒容密閉容器中進行,測得2min內,H2的物質的量由20mol減少到8mol,則2min內NH3的化學反應速率為
A.0.4mol·(L·min)1B.1.8mol·(L·min)1
C.1.2mol·(L·min)1D.0.6mol·(L·min)1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定溫度下,將一定量的氣體通入體積為2L的密閉容器中,使其發生反應,有關物質X、Y、Z的物質的量的變化如圖所示。則下列有關推斷正確的是

A.t時,X、Y、Z的質量不再改變
B.該反應的化學方程式為:3Z=3X+2Y
C.t時,Z的濃度為1.2mol/L
D.t時,反應停止,反應速率為0
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】拉曼光譜證實,AlO2-在水中轉化為[Al(OH)4]-。將一定量的Na2CO3、NaAlO2固體混合物溶于適量水中,再逐滴加入1mol/L鹽酸,測得溶液中CO32-、HCO3-、[Al(OH)4]-、Al3+的物質的量與加入鹽酸的體積變化關系如圖所示,則下列說法正確的是
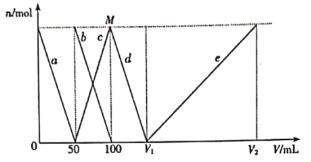
A.CO32-、HCO3-和[Al(OH)4]-在水溶液中可大量共存
B.d線表示的反應為:[Al(OH)4]-+H+=Al(OH)3↓+H2O
C.原固體混合物中CO32-與AlO2-的物質的量之比為1:1
D.V1=150mL,V2=300mL;M點生成的CO2為0.05mol
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com