
【題目】某化學興趣小組同學展開對漂白劑亞氯酸鈉(NaClO2)的研究。

已知:①NaClO2飽和溶液在溫度低于38℃時析出晶體是NaClO23H2O,高于38℃時析出晶體是NaClO2,高于60℃時NaClO2分解成NaClO3和NaCl;
②二氧化氯極易溶于水。
(1)裝置A中NaClO3和Na2SO3制備ClO2氣體,其物質的量的理論比值為____________;該裝置中采用濃硫酸而不用稀硫酸的原因是___________。
(2)裝置B的作用是 _____________;裝置C中反應為放熱反應,在不改變反應物濃度和體積的條件下,為了使反應在低溫下進行,實驗中可采取的措施是________________。
(3)寫出裝置C發生的離子方程式______________。
(4)從裝置C反應后的溶液獲得干燥的NaClO2晶體的操作步驟為:將裝置C中的液體取出在減壓和55℃條件下蒸發,至出現大量晶體后,___________________(填實驗步驟)。(已知:NaClO2晶體易溶于水,難溶解于乙醇等有機溶劑。)
【答案】 2:1 減少ClO2在水中的溶解 防止倒吸 給C裝置加冰水浴、緩慢滴加硫酸 2ClO2 +H2O2 +2OH-= 2ClO2-+ O2↑+ 2H2O 在漏斗中高于 38℃趁熱過濾;乙醇洗滌 2~3 次;低于 60℃干燥,得到成品
【解析】本題主要考查對于“對漂白劑亞氯酸鈉(NaClO2)的研究”探究實驗的評價。
(1)裝置A中NaClO3和Na2SO3制備ClO2氣體,從化合價升降總數相等可知其物質的量的理論比值為2:1;該裝置中采用濃硫酸而不用稀硫酸的原因是減少ClO2在水中的溶解。
(2)裝置B的作用是防止倒吸;裝置C中反應為放熱反應,在不改變反應物濃度和體積的條件下,為了使反應在低溫下進行,實驗中可采取的措施是給C裝置加冰水浴、緩慢滴加硫酸。
(3)裝置C發生反應的離子方程式:2ClO2 +H2O2 +2OH-= 2ClO2-+ O2↑+ 2H2O。
(4)從裝置C反應后的溶液獲得干燥的NaClO2晶體的操作步驟為:將裝置C中的液體取出在減壓和55℃條件下蒸發,至出現大量晶體后,在溫度高于38℃條件下趁熱過濾,用乙醇洗滌2~3次,在溫度低于60℃條件下干燥,得到成品。


 優生樂園系列答案
優生樂園系列答案科目:高中化學 來源: 題型:
【題目】某金屬與氯氣反應生成的化合物中,其質量比為1∶1.9,原子個數比為1∶3,則金屬的相對原子質量為
A. 27 B. 56 C. 23 D. 64
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鎂的單質及其化合物在儲氫及大氣治理等方面用途非常廣泛。
I.工業上可以采用熱還原法制備金屬鎂(沸點1107℃,熔點648.8℃)。 將堿式碳酸鎂[4MgCO3·Mg(OH)2·5H2O]和焦炭按一定比例混合,放入真空管式爐中先 升溫至700℃保持一段時間,然后升溫至1450℃反應制得鎂(同時生成可燃性氣體)。
(1)用碳還原法制備金屬鎂需要在真空中而不在空氣中進行,其原因是____________。
(2)堿式碳酸鎂分解如圖所示,寫出在1450℃反應制得鎂的化學方程式:_____________。

II.工業上利用納米MgH2和LiBH4組成的體系儲放氫(如題圖所示)。

(3)寫出放氫過程中發生反應的化學方程式:___________。
III.工業上MgO漿液是高活性的脫硫劑,常用來脫除煙氣中的SO2。主要包含的反應有: ① Mg(OH)2+ SO2=MgSO3+H2O ② MgSO3+SO2+H2O= Mg(HSO3)2 ③ Mg(HSO3)2+ Mg(OH)2=2MgSO3+2H2O ④ 2MgSO3+O2=2MgSO4
脫硫時,MgO的脫硫效率、pH及時間的關系如題圖所示。

己知20℃時,H2SO3的K1=l.54×10-2,K2=1.02×10-7,25℃時,Ksp[MgSO3]= 3.86×10-3,Ksp(CaSO3)= 3.1×10-7。
(4)脫硫過程中使漿液pH減小最顯著的反應是______________(填①、②、③或④)。
(5)約9000s之后,脫硫效率開始急速降低,其原因是______________。
(6)其他條件相同時,鎂基和鈣基脫硫效率與液、氣摩爾流量比如題圖所示。鎂基脫硫效率總比鈣基大,除生成的MgSO4具有良好的水溶性外,還因為______________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】0.5 L 2 mol·L-1FeCl3溶液與0.2 L 5 mol·L-1KCl溶液中的Cl﹣物質的量之比( )
A. 6∶5 B. 3∶2 C. 15∶2 D. 3∶1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A.【物質結構與性質】
甲基呋喃與氨在高溫下反應得到甲基吡咯:

![]()
(1)Zn的基態原子核外電子排布式為______________。
(2)配合物[Zn(NH3)3(H2O)]2+中,與Zn2+形成配位鍵的原子是_____________(填元素符號)。
(3)1 mol甲基呋喃分子中含有σ鍵的數目為_______________mol。
(4)甲基吡咯分子中碳原子軌道的雜化軌道類型是____________。與NH3分子互為等電子體的陽離子為_____________。
(5)甲基吡咯的熔沸點高于甲基呋喃的原因是____________。
(6)鋅的某種化合物晶胞結構如圖所示,則構成該化合物的兩種粒子個數比為____________
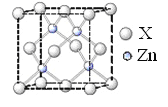
B.【實驗化學】
硫酰氯(SO2Cl2)可用作有機化學的氯化劑,在藥物和染料的制取中也有重要作用。某化學學習小組擬用干燥的Cl2和SO2在活性炭催化下制取硫酰氯。反應的化學方程式為:SO2(g)+ Cl2(g) =SO2Cl2(l) ΔH =97.3 kJ·mol1,實驗裝置如圖所示(部分夾持裝置未畫出)。

已知:硫酰氯通常條件下為無色液體,熔點54.1℃,沸點69.1℃。在潮濕空氣中“發煙”;100°C以上開始分解,生成二氧化硫和氯氣,長期放置也會發生分解。
回答下列問題:
(1)裝置丙的冷凝管中冷凝水的入口是_____________(填“a”或“b”),裝置己的作用是____________;如何控制兩種反應物體積相等:______________。
(2)裝置戊上方分液漏斗中最好選用下列試劑:_____________(選填字母)。
A.蒸餾水 B.飽和食鹽水 C.濃氫氧化鈉溶液 D.6.0 molL1鹽酸
(3)若缺少裝置乙和丁(均盛放濃硫酸),潮濕氯氣和二氧化硫發生反應的化學方程式是_____________。
(4)氯磺酸(ClSO3H)加熱分解,也能制得硫酰氯:2ClSO3H![]() SO2Cl2 + H2SO4,分離兩種產物的方法是____________(選填字母)。
SO2Cl2 + H2SO4,分離兩種產物的方法是____________(選填字母)。
A.重結晶 B.過濾 C.蒸餾 D.萃取
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上制硫酸的主要反應之一為2SO2(g)+O2(g)![]() 2SO3(g),反應過程中能量的變化如圖所示。
2SO3(g),反應過程中能量的變化如圖所示。

(1)由圖可知該反應的正反應為______________(填“吸熱”或“放熱”)反應。
(2)向反應體系中加入催化劑后,圖中E1__________(填“增大”“減小”或“不變”,下同),E3________________。
(3)已知:2H2S(g)+O2(g)==2S(s)+2H2O(g) △H=-442.4kJmol-1;
S(s)+O2(g)==SO2(g) △H=-297.0kJmol-1。
則H2S(g)與O2(g)反應產生SO2(g)和H2O(g)的熱化學方程式是______________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:乙烯可被酸性高錳酸鉀溶液氧化為CO2。可以用來除去甲烷中混有的乙烯的是 ( )
A.通入足量酸性KMnO4溶液B.通入足量的溴水
C.在一定條件下通入H2D.將其分別點燃
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com