
| A.N2(g) + 2O2(g) = 2NO2(g) △H =" +" 67.7 kJ/mol |
| B.CaCO3(s) =CaO(s) +CO2(g) △H =" +" 1921.8 kJ/mol |
| C.C6H12O6 ( s ) + 6O2 ( g ) = 6CO2 (g) + 6H2O ( l )△H =" -2804" kJ/mol |
| D.2CO(g)+O2 (g)=2CO2(g)△H= -566 kJ/mol |
科目:高中化學 來源:不詳 題型:單選題
| A.吸熱的化學反應,常溫下可能自發 |
| B.熵增加的反應,常溫下一定能自發 |
| C.自發反應只有在恰當條件下才能實現 |
| D.若ΔH>0,ΔS<0,任何條件下都不能自發進行 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.使用催化劑,可降低反應的活化能,加快反應速率,改變反應限度 |
| B.依據焓判據:NH4HCO3受熱分解可自發進行 |
| C.大多數化學反應在一定條件下都有一定的限度 |
| D.FeCl3與KSCN反應達到平衡時,向其中滴加KCl溶液,則溶液顏色變深 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.某反應低溫條件下能自發進行,那么高溫條件也一定能自發進行 |
| B.某反應高溫條件下不能自發進行,那么低溫條件也不能自發進行 |
| C.反應方向是由焓變和熵變共同決定的,與反應溫度無關 |
| D.溫度有可能對反應的方向起決定性的作用 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
 2C(g),在不同溫度下經過一定時間,混合物中C的體積分數與溫度的關系如圖所示。填寫下列空白:
2C(g),在不同溫度下經過一定時間,混合物中C的體積分數與溫度的關系如圖所示。填寫下列空白: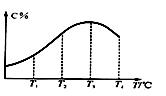
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.在相同條件下,焓變小于0而熵變大于0的反應肯定能自發進行 |
| B.升高溫度會加快化學反應速率,其原因是增加了活化分子的百分數 |
| C.沉淀轉換的實質就是沉淀溶解平衡的移動,平衡一般向生成更難溶物質的方向移動 |
| D.PH為10的氨水,由水電離出的氫氧根離子濃度為10-4 mol/L |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.向水中加NaHCO3 | B.向水中加NaHSO4 |
| C.向水中加FeCl3 | D.向水中加CaO |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
 (g)
(g) CO(g)+3H2(g)△H>0,達到平衡狀態。下列敘述正確的是 ( )
CO(g)+3H2(g)△H>0,達到平衡狀態。下列敘述正確的是 ( )| A.增加甲烷的量,上式中△H增大 |
| B.增大水蒸氣的量,可提高水蒸氣的轉化率 |
| C.升高溫度,逆反應速率增大,正反應速率減少 |
| D.增大體系壓強,該反應的化學平衡常數不變 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com