
【題目】下列實驗操作不是從安全角度考慮的是
A.用氯酸鉀和二氧化錳制氧氣時用排水法收集后,應從水中撤出導管后再停止加熱
B.酒精燈在不使用時,必須蓋上燈帽
C.實驗室制備CO氣體必須在通風櫥中進行
D.蒸餾操作時應在混合液中加入沸石
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】五種短周期主族元素W、M、X、X、Z原子序數依次增大,請結合表中信息回答下列問題:
元素 | W | M | X | Y | Z |
結構或性質 | 最高價含氧酸與其氣態氫化物能發生化合反應 | 氫化物的水溶液能刻蝕玻璃 | 焰色反應呈火焰黃色 | 同周期主族元素形成的簡單離子中,其離子半徑最小 | 最高正價與最低負價代數和為6 |
(1)M元素在周期表中的位置為____________。
(2)M、X、Z元素所對應簡單離子半徑由大到小的順序為__________(用離子符號表示)。
(3)W最高價含氧酸與其氣態氫化物發生化合反應生成的物質中含有的化學鍵類型為_____。
(4)下列可作為比較M和Z的非金屬性強弱的依據是_______(填序號)。
A.單質與H2反應的難易程度 B.氫化物的穩定性
C.最高價氧化物的水化物酸性強弱 D.將M的單質通入Z的鈉鹽溶液觀察是否有Z逸出
(5)常溫下,4.6gX單質在空中燃燒,再恢復到常溫,放出QkJ能量,該反應的熱化學方程式為_______________。
(6)W能形成多種氫化物,其中-種氫化物可作為火箭燃料,該物質中W與氫元素的質量比為7:1,寫出該氫化物的電子式___________。該氫化物和O2在堿性條件下可形成燃料電池,產生兩種無毒物質,寫出其負極的電極反應式____________。
(7)Y元素和W元素形成的化合物YW一種新型無機材料,可與過量燒堿溶液反應產生使濕潤的紅色石蕊試紙變藍的氣體,寫出有關的化學方程式___________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】燃燒a g乙醇(液態),生成二氧化碳氣體和液態水,放出的熱量為Q kJ,經測定,a g乙醇與足量鈉反應,能生成標準狀況下的氫氣5.6L,則表示乙醇燃燒熱的熱化學方程式書寫正確的是( )
A.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) △H = -Q kJ/mol
B.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) △H = - Q / 2 kJ/mol
C.![]() C2H5OH(l)+
C2H5OH(l)+ ![]() O2(g)=CO2(g)+3/2H2O(l) △H = -Q kJ/mol
O2(g)=CO2(g)+3/2H2O(l) △H = -Q kJ/mol
D.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) △H = -2Q kJ/mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A.膠體與溶液的本質區別在于是否具有丁達爾效應
B.電解質電離需要通電才能實現
C.只含有一種元素的物質一定是純凈物
D.向Fe(OH)3膠體中逐滴滴加稀硫酸,先出現沉淀,后來沉淀溶解
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法錯誤的是( )
A. 實驗室配制FeCl3溶液時,需將FeCl3 (s)溶解在較濃鹽酸中,然后加水稀釋
B. 反應2CO+2NO = N2+2CO2在常溫下能自發進行,則反應的![]() H>0,
H>0,![]() S<0
S<0
C. 0.1mol·L-1NH4Cl溶液加水稀釋,c(H+)/c(NH4+)的值增大
D. 反應CH3COOCH3+H2O![]() CH3COOH+CH3OH
CH3COOH+CH3OH ![]() H>0,達到平衡時,加入少量固體NaOH,則乙酸甲酯水解轉化率增大
H>0,達到平衡時,加入少量固體NaOH,則乙酸甲酯水解轉化率增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】
(1)丙烷燃燒可以通過以下兩種途徑:
途徑I:C3H8(g) + 5O2(g) = 3CO2(g) +4H2O(l) ΔH=-a kJ·mol-1
途徑II:C3H8(g) = C3H6(g)+ H2(g) ΔH=+b kJ·mol-1
2C3H6(g)+ 9O2(g) = 6CO2(g) +6H2O(l) ΔH=-c kJ·mol-1
2H2(g)+O2 (g) = 2H2O(l) ΔH=-d kJ·mol-1 (abcd均為正值)
請回答下列問題:
①判斷等量的丙烷通過兩種途徑放出的熱量,途徑I放出的熱量(填“大于”、“等于”或“小于”)途徑II放出的熱量。
②b 與a、c、d的數學關系式是 。
(2)甲醇是一種重要的試劑,有著廣泛的用途,工業上可利用CO2制備甲醇。用CH4與CO2反應制H2和CO,再利用H2和CO化合制甲醇。已知:
① 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H1=-1450.0kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g) △H2=-566.0kJ·mol-1
③ 2H2(g)+O2(g)=2H2O(l) △H3=-571.6kJ·mol-1
則H2和CO制液態甲醇的熱化學方程式為。
(3)如圖所示,某同學設計一個甲醚(CH3OCH3)燃料電池并探究氯堿工業原理和粗銅的精煉原理,其中乙裝置中X為陽離子交換膜.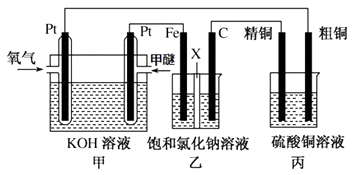
報據要求回答相關問題:
①寫出甲中通甲醚一極的電極反應式。
②乙中發生的總反應的離子方程式為。
③將0.2mol AgNO3、0.4mol Cu(NO3)2 、0.6mol KCl溶于水,配成100ml溶液,用惰性電極電解一段時間后,某一電極上析出了0.3mol Cu,此時在另一電極上產生的氣體體積(標準狀況)為 L,若要使電解質溶液恢復到電解前的狀態,需要加入固體的質量為g 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表是25 ℃時某些弱酸的電離平衡常數。
化學式 | CH3COOH | HClO | H2CO3 | H2C2O4 |
Ka | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 | Ka1=5.9×10-2 |
(1)H2C2O4與含等物質的量的KOH的溶液反應后所得溶液呈酸性,該溶液中各離子濃度由大到小的順序為。
(2)向0.1 mol·L-1 CH3COOH溶液中滴加NaOH溶液至c(CH3COOH)∶c(CH3COO-)=5∶9,此時溶液pH=。
(3)向碳酸鈉溶液中滴加少量氯水的離子方程式為。
(4)若0.1mol·L-1CH3COOH溶液與0.1mol·L-1NaOH溶液等體積混合(忽略混合后溶液體積的變化),測得混合溶液的pH=8,則c(Na+)-c(CH3COO-)=mol·L-1(填精確計算結果)。
(5)將CH3COOH溶液與大理石反應所產生的標況下44.8L氣體全部通入到2L 1.5mol/L的NaOH溶液中充分反應,則溶液中所有離子的物質的量濃度由大到小的順序為。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】溶液中只可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的幾種。①若加入鋅粒,產生無色無味的氣體;②若加入NaOH溶液,產生白色沉淀,且產生的沉淀量與加入NaOH的物貭的量之向的關系如圖所示。則下列説法正確的是( )

A. 溶液中的陽離子一定含有H+、Mg2+、Al3+,可能含有Fe3+
B. 溶液中一定不含CO32-和NO3-,一定含有SO42-
C. 溶液中C(NH4+)=0.2mol/L
D. c(H+):c(Al3+):c(Mg2+)=l:1:1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】澳大利亞研究人員最近開發出被稱為第五形態的固體碳,這種新的碳結構稱作“納米泡沫”,它外形類似海綿,比重極小,并具有磁性.納米泡沫碳與金剛石的關系是( )
A.同一種物質
B.同分異構體
C.同位素
D.同素異形體
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com