
【題目】非諾洛芬是一種治療類風濕性關節炎的藥物,可通過以下方法合成:

請回答下列問題:
(1)非諾洛芬中的含氧官能團為________________(填名稱)。
(2)反應①中加入的試劑X的分子式為C8H8O2,X的結構簡式為______________。
(3)在上述五步反應中,屬于取代反應的是_______________(填序號)。
(4)B的一種同分異構體滿足下列條件:
Ⅰ、能發生銀鏡反應,其水解產物之一能與FeCl3溶液發生顯色反應。
Ⅱ、分子中有6種不同化學環境的氫,且分子中含有兩個苯環。
寫出該同分異構體的結構簡式:_______________。
(5)根據已有知識并結合相關信息,寫出以 為原料制備
為原料制備 的合成路線流程圖(無機試劑任用)。合成路線流程圖示例如下:
的合成路線流程圖(無機試劑任用)。合成路線流程圖示例如下:
![]()
合成路線流程圖第一步已給出,請補充完整。
 _________________________________________。
_________________________________________。
【答案】 醚鍵、羧基  ①③④
①③④ 

【解析】由合成流程圖可知,A發生取代反應生成B,然后依次發生還原反應,取代反應,取代反應,水解反應生成非諾洛芬。則
(1)由結構簡式可知非諾洛芬中的官能團為醚鍵、 羧基。(2)A發生取代反應生成B,根據AB分子式的差異并結合X的分子式知,在B的醚鍵處斷鍵,使醚基轉化為酚羥基連接在X上,所以X的結構簡式為 ;(3)①為取代反應,②為加成反應,③為取代反應,④為取代反應,⑤為水解反應其實質是先加成后取代,所以取代反應的有①③④;(4) 能發生銀鏡反應,說明含有醛基,其水解產物之一能與氯化鐵發生顯色反應,說明含有酚羥基,分子中有6種不同化學環境的氫,且分子中含有兩個苯環,說明該分子中含有兩個苯環且氫原子種類是6,則符合條件的結構簡式為
;(3)①為取代反應,②為加成反應,③為取代反應,④為取代反應,⑤為水解反應其實質是先加成后取代,所以取代反應的有①③④;(4) 能發生銀鏡反應,說明含有醛基,其水解產物之一能與氯化鐵發生顯色反應,說明含有酚羥基,分子中有6種不同化學環境的氫,且分子中含有兩個苯環,說明該分子中含有兩個苯環且氫原子種類是6,則符合條件的結構簡式為 。(5)苯乙醛和NaBH4發生還原反應生成苯乙醇,苯乙醇發生消去反應生成苯乙烯,苯乙烯發生加成反應生成
。(5)苯乙醛和NaBH4發生還原反應生成苯乙醇,苯乙醇發生消去反應生成苯乙烯,苯乙烯發生加成反應生成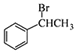 ,
, 和NaCN發生水解反應生成
和NaCN發生水解反應生成 ,即合成路線圖為
,即合成路線圖為 。
。


 手拉手全優練考卷系列答案
手拉手全優練考卷系列答案科目:高中化學 來源: 題型:
【題目】石墨烯鋰-硫電池是一種高容量、長循環壽命、低成本及環境友好的新型二次電池,該電池結構如圖所示,電池反應為2Li +nS![]() Li2Sn。有關該電池的說法正確的是
Li2Sn。有關該電池的說法正確的是

A. 放電時,Li+向負極遷移
B. 充電時,A電極連接電源的負極
C. 充電時,每生成n mol S轉移2n mol電子
D. 放電時,正極上可發生反應2Li+ +2Li2S6+2e-=3Li2S4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將一定量Fe和Fe2O3混合物放入2mol·L-1的HNO3溶液25 mL中,反應完成后,無固體剩余,生成224 mL NO氣體(標準狀況),再向反應后的溶液中加入1 mol·L-1的NaOH溶液,要使鐵元素全部沉淀下來,所加NaOH溶液的體積最少是( )
A.45 mL B.50 mL C.40 mL D.無法確定
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】歐盟原定于2012年1月1日起征收航空碳排稅以應對冰川融化和全球變暖,使得對如何降低大氣中CO2的含量及有效地開發利用碳資源的研究顯得更加緊迫。請運用化學反應原理的相關知識研究碳及其化合物的性質。
(1)用電弧法合成的儲氫納米碳管常伴有大量的碳納米顆粒(雜質),這種顆粒可用如下氧化法提純,請完成該反應的化學方程式:
___ C+ ___ KMnO4+ ____ H2SO4→____CO2↑+ ____MnSO4+ ____K2SO4+ ____H2O
(2)焦炭可用于制取水煤氣。測得12 g碳與水蒸氣完全反應生成水煤氣時,吸收了131.6 kJ熱量。該反應的熱化學方程式為______________________________________________________。
(3)工業上在恒容密閉容器中用下列反應合成甲醇:
CO(g)+2H2(g)![]() CH3OH(g) △H=akJ/mol 。
CH3OH(g) △H=akJ/mol 。
下表所列數據是反應在不同溫度下的化學平衡常數(K)。
溫度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
①判斷反應達到平衡狀態的依據是_____________。
A.生成CH3OH的速率與消耗CO的速率相等
B.混合氣體的平均相對分子質量不變
C.混合氣體的密度不變
D.CH3OH、CO、H2的濃度都不再發生變化
②某溫度下,將2 mol CO和一定量的H2充入2 L的密閉容器中,充分反應10min后,達到平衡時測得c![]() mol/L,則以H2表示的反應速率v(H2)=___________。
mol/L,則以H2表示的反應速率v(H2)=___________。
(4)CO還可以用做燃料電池的燃料,某熔融鹽燃料電池具有高的發電效率,因而受到重視,該電池用Li2CO3和Na2CO3的熔融鹽混合物作電解質,CO為負極燃氣,空氣與CO2的
混合氣為正極助燃氣,制得在650 ℃下工作的燃料電池,其正極反應式:
O2+ 2CO2+4e-=2CO32-,則負極反應式:______________________________________。
(5)向BaSO4沉淀中加入飽和碳酸鈉溶液,充分攪拌,棄去上層清液,如此處理多次,可使BaSO4全部轉化為BaCO3,發生反應:BaSO4(s)+CO32-(aq) ![]() BaCO3(s)+SO42-(aq)。已知某溫度下該反應的平衡常數K=4.0×10-2,BaSO4的Ksp=1.0×10-10,則 BaCO3的溶度積Ksp=___________。
BaCO3(s)+SO42-(aq)。已知某溫度下該反應的平衡常數K=4.0×10-2,BaSO4的Ksp=1.0×10-10,則 BaCO3的溶度積Ksp=___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】直接尿素電池的結構如圖所示,下列說法不正確的是

A. 碳電極采用多孔并用觸媒層可加快反應速率
B. 電池工作時,化學能轉化為電能
C. Y極的電極反應式為H2NCONH2+H2O-6e-=N2↑+CO2+6H+
D. 電池工作時,H+向Y極區遷移,Y極周圍溶液的pH減小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鐵粉、銅粉混合物樣品11.6 g,逐滴加入2.0 mol·L-1的硫酸溶液,充分反應后剩余固體質量隨加入硫酸溶液體積變化如下表:
硫酸溶液/mL | 20.0 | 40.0 | 60.0 | 80.0 |
剩余固體/g | 9.36 | 7.12 | 4.88 | 3.20 |
請回答:
(1)樣品中鐵與銅的物質的量之比n(Fe)∶n(Cu)=________。
(2)在反應后的體系中,再加入4.0 mol·L-1的H2O2溶液25.0 mL,并加入足量硫酸溶液。充分反應后溶液中存在的各金屬離子的物質的量分別是多少?__________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】小明同學在“金屬拓展閱讀”活動中了解到:金屬鈉在常溫下與水劇烈反應能生成一種可燃性氣體。教師結合小明已有知識設計了下圖所示裝置進行實驗。
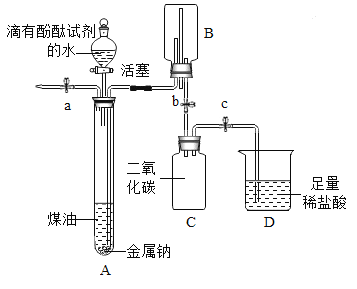
【小資料】金屬鈉一般存放在煤油中或用石蠟封存,煤油的密度為0.8g/mL。
(1)問題:采取上述保存金屬鈉的方法中,煤油或石蠟的作用是__________。
(2)實驗過程
操作 | 現象及解釋 | |
① | 打開止水夾a及分液漏斗活塞,待液體充滿大試管后,關閉止水夾a及分液漏斗活塞。 | 液體分層,鈉熔成銀白色小球,在液體分層的界面上方跳動,產生大量氣泡,下層溶液變成紅色,并逐漸被壓入B中。由此可知金屬鈉的物理性質_______(寫出一點即可)。 |
② | 打開止水夾b,待B中部分溶液進入C中,迅速關閉止水夾b。 | 反應的化學方程式為_____________. |
③ | 打開止水夾c。 | _______,溶液紅色消失。 反應的化學方程式為_________。 |
④ | 將燃著的木條伸到導管尖嘴處,打開止水夾a; 在火焰上方罩一個干冷的燒杯。 | 氣體燃燒,產生淡藍色火焰 燒杯內壁有無色液滴生成,A中氣體為氫氣。 |
(3)反思分析
金屬鈉與水反應的化學方程式為_____________;
反應結束,C中溶液的溶質是_________(指示劑除外,寫出所有可能)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】近日,霧霾又上了度娘熱搜榜。其主要成分包括灰塵、SO2、NOx、有機碳氫化合物等粒子。煙氣脫硝是治理霧霾的方法之一。
(1)氨氣是常見的煙氣脫硝劑之一,其脫硝原理是與NO(g)反應生成空氣中存在的兩種無毒物質。
①寫出該反應的化學反應方程式:_____________。
②已知:4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H1=-907.28kJ mol-1;
4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H2= -1269.02kJ mol-1。105℃時,則上述脫硝反應的△H=_______,該反應________(填“能” “否”或“不能確定”)自發進行,
③上述脫硝反應中氧化劑和還原劑的物質的量之比為________。每生成1mol還原產物,則反應中轉移電子數為_________mol。
(2)臭氧也是理想的煙氣脫硝劑,其脫硝的反應之一為2NO2(g)+O3(g)![]() N2O5(g)+O2(g),不同溫度下,在兩個恒容容器中發生上述反應,相關信息如下表及圖所示,回答下列問題:
N2O5(g)+O2(g),不同溫度下,在兩個恒容容器中發生上述反應,相關信息如下表及圖所示,回答下列問題:
容器 | 甲 | 乙 |
容積/L | 1 | 1 |
溫度/K | T1 | T2 |
起始充入量 | lmolO3 2mol NO2 | lmolO3 2mol NO2 |

0~10min內甲容器中反應的平均速率:v(O3) =_______mol·L-1·min-1 。
②T1________T2 (填“>”“<”或“=”),T1時,該反應的平衡常數為____________。
③下列措施能提高容器乙中NO2轉化率的是________(填序號)。
A.向容器中充入He,增大容器的壓強
B.升高容器的溫度
C.向容器中再充人一定量的NO2
D.向容器中再充入lmol O3和2mo NO2
④T1時,若起始時向容器甲中充入2mo1 NO2、lmolO3、2mollN2O5和2molO2,則脫硝反應達到平衡前,v(正)________v(逆) (填“>”“<”“=”)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com