
【題目】A、 B、 C、 D、 E、 F 為前四周期元素且原子序數依次增大,其中基態 A 原子的電子分布在 3 個能級,且每個能級所含的電子數相同; C 的原子核外最外層有 6 個運動狀態不同的電子; D 是短周期元素中電負性最小的元素; E 的最高價氧化物的水化物酸性最強; 基態 F 原子核外最外層只有一個電子, 其余能層均充滿電子。 G 元素與 D 元素同主族,且相差 3 個周期。
(1)元素 A、 B、 C 的第一電離能由小到大的是____________________(用元素符號表示)。
(2)E的最高價含氧酸中 E 原子的雜化方式為_____________。 基態 E 原子中,核外電子占據最高能級的電子云輪廓形狀為____________________________。
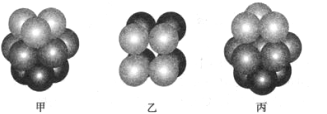
(3)F原子的外圍電子排布式為_______________________, F 單質晶體中原子的堆積方式是下圖中的_______(填寫“甲”、 “乙”或“丙”) ,該晶體的空間利用率為_____________。(保留兩位有效數字)
(4)已知元素 A、B形成的(AB)2分子中所有原子都滿足 8電子穩定結構,則其分子中 σ鍵與 π鍵數目之比為__________。
(5)通常情況下, D 單質的熔沸點比 G 單質高,原因是_________________________。
(6)已知 DE 晶體的晶胞如下圖所示:
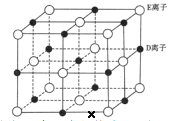
若將 DE 晶胞中的所有 E 離子去掉,并將 D 離子全部換為 A 原子,再在其中的 4 個“小立方體”中心各放置一個A 原子,且這 4 個“小立方體”不相鄰。位于“小立方體”中的 A 原子與最近的 4 個 A 原子以單鍵相連,由此表示 A的一種晶體的晶胞(已知 A—A 鍵的鍵長為a cm, NA表示阿伏加德羅常數),則該晶胞中含有_________個 A 原子,該晶體的密度是______________g·cm-3(列式表示) 。
【答案】 C sp3 啞鈴型 3d104s1 丙 74% 3:4 Na、Cs處于同一主族,并都是金屬晶體,同主族元素價電子數相同,從上到下,原子半徑依次增大,金屬鍵依次減弱,熔沸點降低 8 ![]()
【解析】基態A原子的電子分布在3個能級,且每個能級所含的電子數相同,即1s22s22p2,則A為C元素,原子序數大于6,最外層有6個運動狀態不同的電子,說明C為O元素,所以B為N元素,D是短周期元素中電負性最小的元素,即為Na元素,E的最高價氧化物的水化物酸性最強,即為Cl元素,基態F原子核外最外層只有一個電子,其余能層均充滿電子,則其電子排布為[Ar]3d104s1,即29號元素Cu,G元素與Na元素同主族,且相差3個周期,則G為Cs元素。由此分析如下:
(1)同周期元素的第一電離能從左到右一般是依次增大的,但由于N元素最外層是半滿狀態,所以其電離能大于O元素的,因此C、N、O三種元素的第一電離能由小到大的是C<O<N;
(2)Cl元素形成的HClO4中Cl原子以sp3的雜化方式形成四個共價鍵,Cl原子占據最高能級為3p能級,其電子云輪廓形狀為啞鈴型(或紡綞體型);
(3)Cu原子的外圍電子排布式為 3d104s1,單質銅的晶體中原子的堆積方式為面心立方,即圖丙,這種晶體的空間利用率為74%;
(4)由C、N形成的(CN)2分子的結構簡式為NC—CN,其中含有3個σ單鍵和4個π鍵,所以 σ鍵與π鍵數目之比為3:4;
(5) Na、Cs都屬于堿金屬元素,最外電子數相同,但從上到下,隨電子層數增多,原子半徑增大,導致金屬鍵減弱,因此單質的熔沸點降低;
(6)根據題目敘述,該晶胞中的C原子分布在棱的中點、體心和4個“小立方體”的中心,根據原子均灘法可得該晶胞中的C原子數=![]() +1+4=8,其質量為
+1+4=8,其質量為![]() g ,根據A—A單鍵的鍵長可求得該晶胞的棱長為
g ,根據A—A單鍵的鍵長可求得該晶胞的棱長為![]() cm,體積為
cm,體積為![]() ,所以該晶胞的密度為
,所以該晶胞的密度為![]() g/cm3。
g/cm3。


 開心蛙狀元測試卷系列答案
開心蛙狀元測試卷系列答案科目:高中化學 來源: 題型:
【題目】現有四種元素的基態原子的電子排布式如下:
①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p3;④1s22s22p5。
則下列有關比較中正確的是( )
A. 電負性:④>③>②>① B. 原子半徑:④>③>②>①
C. 第一電離能:④>③>②>① D. 最高正化合價:④>③=②>①
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】3.9克的鎂鋁合金,投入到500mL 2mol/L的鹽酸中,金屬完全溶解,再加入4mol/L的氫氧化鈉溶液,若要生成沉淀最多,加入這種氫氧化鈉溶液的體積是()
A.125mL B.200mL C.250mL D.560mL
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硅是無機非金屬材料的主角,硅的氧化物和硅酸鹽約占地殼質量的90%以上。
(1)下列物質不屬于硅酸鹽的是____。
A.陶瓷 B.玻璃 C.水泥 D.生石灰
(2)SiO2是玻璃的主要成分之一,SiO2與氫氧化鈉溶液反應的化學方程式為____________________,工藝師常用______(填物質名稱)來雕刻玻璃。
(3)用Na2SiO3水溶液浸泡過的棉花不易燃燒,說明Na2SiO3可用作______。Na2SiO3可通過SiO2與純堿混合高溫熔融反應制得,高溫熔融純堿時下列坩堝可選用的是___。
A.普通玻璃坩堝 B.石英玻璃坩堝 C.瓷坩堝 D.鐵坩堝
(4)工業上常利用反應2C+SiO2![]() Si+2CO↑制備硅單質,該反應中所含元素化合價升高的物質是___(填化學式,下同),氧化劑是____
Si+2CO↑制備硅單質,該反應中所含元素化合價升高的物質是___(填化學式,下同),氧化劑是____
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】當反應 COCl2(g)![]() CO(g)+Cl2(g) ΔH>0達到平衡時,分別只再采取下列措施:①升溫;②恒容通入惰性氣體;③增加CO濃度;④減壓;⑤加催化劑;⑥恒壓通入惰性氣體。其中,能提高COCl2轉化率的措施是( )
CO(g)+Cl2(g) ΔH>0達到平衡時,分別只再采取下列措施:①升溫;②恒容通入惰性氣體;③增加CO濃度;④減壓;⑤加催化劑;⑥恒壓通入惰性氣體。其中,能提高COCl2轉化率的措施是( )
A. ①②④ B. ①④⑥ C. ②③⑤ D. ③⑤⑥
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA表示阿伏加德羅常數的值,下列說法中正確的( )
①常溫常壓下,11.2 L乙烷所含的分子數為0.5NA
②14.2g 硫酸鈉固體中含有0.1NA個硫酸鈉分子:
③常溫下,21gC3H6和C4H8的混合物中含有的碳原子數為1.5NA
④2gD216O中含有的質子數、中子數、電子數均為NA
⑤標準狀況下,由H2O2分解制得4.48LO2轉移的電子數目為0.2NA
⑥10ml 18mol/L 的濃硫酸與足量的鎂反應時轉移的電子數為0.18NA
A. ③④ B. ①⑥ C. ④⑤⑥ D. ①②⑥
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】霧霾天氣嚴重影響人們的生活,其中氮氧化物和硫氧化物是造成霧霾天氣的主要原因之一。消除氮氧化物和硫氧化物有多種方法
(1)用活性炭還原法可以處理氨氧化物。某研究小組向某密閉容器中加入一定量的活性炭和NO,發生反應:C(s)+2NO(g)![]() N2(g)+CO2(g) △H=Q kJ· mol-1。
N2(g)+CO2(g) △H=Q kJ· mol-1。
在T℃時,反應進行到不同時間測得各物質的濃度如下表。
時間/min 濃度/mol·L-1 | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①0~10min 內,NO 的平均反應速率v(NO)=___________。
T1 ℃時,該反應的平衡常數K=___________。
②30min 后,只改變某一條件,反應重新達到平衡,根據上表中的數據判斷改變的條件可能是(填字母)。___________。
a.加入一定量的活性炭 b.通入一定量的NO
c.適當縮小容器的體積 d.加入合適的催化劑
③若30min 后升高溫度至T2℃,達到平衡時,容器中NO、N2、CO2的濃度之比為5∶3 ∶3,則Q________0(填“>”、“=”或“<”)。
(2)NH3催化還原氮氧化物(SCR)技術是目前應用最廣泛的煙氣氮氧化物脫除技術。反應原理如圖甲所示。
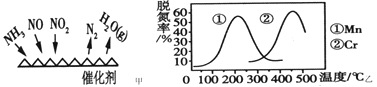
①由圖甲可知,SCR技術中的氧化劑為___________。已知c(NO2)∶c(NO)=1∶1時脫氮效果最佳,若生成1mol N2時反應放出的熱量為QkJ。此時對應的脫氮反應的熱化學方程式為___________。
②圖乙是不同催化劑Mn 和Cr 在不同溫度下對應的脫氮率,由圖可知工業使用的最佳催化劑和相應的溫度分別為________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com