
煤化工中常需研究不同溫度下平衡常數、投料比等問題。
已知:CO (g) +H2O (g) H2 (g) +CO2 (g)平衡常數K隨溫度的變化如下表:
H2 (g) +CO2 (g)平衡常數K隨溫度的變化如下表:
回答下列問題
(1)該反應的平衡常數表達式K= ,ΔH= 0(填“<”、“>”、“=”)
(2)已在一定溫度下,C(s) +CO2 (g) 2CO (g)平衡常數K1;
2CO (g)平衡常數K1;
C (s) +H2O(g) CO(g) +H2 (g)平衡常數K2則K、K1、K2,之間的關系是 :
CO(g) +H2 (g)平衡常數K2則K、K1、K2,之間的關系是 :
(3)8000C時,向一個10L的恒容反應器中充入0.40molCO和1.60mol水蒸氣,經一段時間后反應達到平衡,此時CO的轉化率為 :若保持其他條件不變,向平衡體系中再通入0. 10molCO和0.40molCO2,此時v正 v逆 (填“>”、“=”或“<”)。
(7分)(1) C(CO2)C(H2)/C(CO) C(H2O),(1分) ,< (1分);
(2) K=K2/K1 (1分) (3)80% (2分);=(2分)
解析試題分析:(1)化學平衡常數是在一定條件下,當可逆反應達到平衡狀態時,生成物濃度的冪之積和反應物濃度的冪之積的比值,所以根據反應的化學方程式可知,該反應的平衡常數表達式K= 。根據表中的數據可知,隨著溫度的升高,平衡常數K是減小的,這說明升高溫度平衡向逆反應方向進行,所以正方應是放熱反應,即△H<0。
。根據表中的數據可知,隨著溫度的升高,平衡常數K是減小的,這說明升高溫度平衡向逆反應方向進行,所以正方應是放熱反應,即△H<0。
(2)根據蓋斯定律可知,②-①即得到反應CO (g) +H2O (g) H2 (g) +CO2 (g),所以平衡常數之間的關系是K=K2/K1。
H2 (g) +CO2 (g),所以平衡常數之間的關系是K=K2/K1。
CO (g) +H2O (g) H2 (g) +CO2 (g)
H2 (g) +CO2 (g)
起始濃度(mol/L) 0.040 0.16 0 0
轉化濃度(mol/L) x x x x
平衡濃度(mol/L) 0.040-x 0.16-x x x
則根據該溫度下的平衡常數可知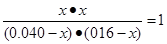
解得x=0.032mol/L
所以CO的轉化率=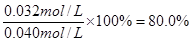
若保持其他條件不變,向平衡體系中再通入0. 10molCO和0.40molCO2,則此時CO、H2O、CO2、H2的濃度分別是(mol/L)0.018、0.128、0.072、0.032,所以Q= ,所以反應仍然是平衡狀態,則正逆反應速率相等。
,所以反應仍然是平衡狀態,則正逆反應速率相等。
考點:考查可逆反應平衡常數的計算、判斷和應用
點評:該題是中等難度的試題,也是高考中的常見題型。試題針對性強,主要是考查學生對平衡常數含義、表達式以及有關應用的熟悉了解程度,旨在培養學生的邏輯思維能力和規范答題能力。在進行可逆反應的有關計算時,一般采用“三段式”進行,即分別列出起始量、轉化量和平衡量或某深刻的量,然后依據已知條件列式計算即可。


科目:高中化學 來源: 題型:填空題
化學在能源開發與利用中起著十分關鍵的作用。氫氣是一種新型的綠色能源,又是一種重要的化工原料。
I.氫氧燃料電池能量轉化率高,具有廣闊的發展前景。現用氫氧燃料電池進行如圖實驗(圖中所用電極均為惰性電極):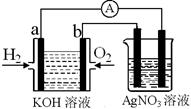
(1)對于氫氧燃料電池中,下列表達不正確的是________
| A.a電極是負極,OH-移向正極 |
| B.b電極的電極反應為:O2+2H2O+4e-=4OH- |
C.電池總反應式為:2H2+O2 2H2O 2H2O |
| D.電解質溶液的pH保持不變 |
 2NH3(g) ΔH=-92.20 kJ·mol-1。
2NH3(g) ΔH=-92.20 kJ·mol-1。| 時間(h) 物質的量(mol) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | n2 | 1.00 | 1.00 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
水煤氣轉化反應CO(g)+H2O(g)  CO2(g)+H2 (g)在一定溫度下達到化學平衡狀態。
CO2(g)+H2 (g)在一定溫度下達到化學平衡狀態。
完成下列填空:
(1)寫出該反應的平衡常數表達式K=________________。
(2)一定溫度下,在一個容積不變的密閉容器中發生上述反應,下列說法中能判斷該反應達到化學平衡狀態的是 (選填編號)。
a.容器中的壓強不變 b.1 mol H-H鍵斷裂的同時斷裂2 molH-O鍵
c.v正(CO) = v逆(H2O) d.c(CO) = c(H2)
(3)將不同量的CO(g)和H2O(g)分別通入到體積為2L的恒容密閉容器中進行反應,得到如下實驗組1和實驗組2的數據:
| 實驗組 | 溫度/℃ | 起始量/mol | 平衡量/mol | 達到平衡所需時間/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 3 |
| 2 | 650 | 1 | 2 | 0.8 | 1.2 | 5 |
| 3 | 950 | 1 | 2 | — | — | — |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
在一定條件下,NO與NO2混合可生成N2O3,反應的化學方程式為:NO(g)+NO2(g) N2O3(g) ΔH<0
N2O3(g) ΔH<0
下圖表示一定量的NO、NO2混合氣體發生反應時,NO2濃度在前25s內的變化。該反應進行到45s時達到平衡,測得NO2濃度約為0.010mol/L。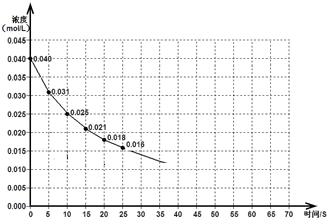
(1)前20s內,NO2的平均反應速率為_________________。
(2)其他條件不變,①升高溫度,NO2的轉化率_______ (填“增大”、“減小”或“不變”)。
②壓縮氣體體積,該反應平衡向_______移動(填“正向”或“逆向”)。
(3)若反應延續至70秒,請在答題卡圖中畫出25秒至70秒的反應進程曲線。
(4)若在反應開始時加入催化劑(其他條件都不變),請在答題卡圖中畫出加催化劑后的反應進程曲線。
(5)NO、NO2的混合氣體用NaOH溶液吸收,得到的鹽只有一種,則該反應的離子方程式為:___________________________________,該反應的氧化劑是______________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
請回答下列問題:
(1)分別用濃、稀硝酸溶解等量的兩份銅粉,消耗硝酸的物質的量較少的是____ 硝酸(填“濃”或“稀”),相應的離子方程式是 。
(2) 800℃時,在2 L的恒容密閉容器中充入2 mol NO和1mol O2發生反應,2NO(g)+O2(g) 2NO2(g),經5min達到平衡,測得c(NO)=0.5mol/L,并放熱Q kJ。
2NO2(g),經5min達到平衡,測得c(NO)=0.5mol/L,并放熱Q kJ。
①5 min內 v(O2)= 。
②該條件下,2NO(g)+O2(g) 2NO2(g)的△H= 。
2NO2(g)的△H= 。
③若向平衡混合物中再充入NO、NO21mol,此時v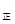 v
v (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
④若向平衡混合物中僅充入1mol NO2,平衡向____ (填“正向”、“逆向”或“不”)移動。達新平衡時,NO2的體積分數____ (填“增大”、“減小”或“不變”)。
(3)染料工業排放的廢水中含有大量有毒的NO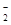 ,可以在強堿性條件下加入鋁粉除去(反應過程中無氣態產物生成。加熱反應后的溶液有能使濕潤的紅色石蕊試紙變藍的氣體逸出)。請寫出該反應的離子方程式____ 。
,可以在強堿性條件下加入鋁粉除去(反應過程中無氣態產物生成。加熱反應后的溶液有能使濕潤的紅色石蕊試紙變藍的氣體逸出)。請寫出該反應的離子方程式____ 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
一定溫度時,在容積一定的密閉容器中,反應A(?)+B(g)  C(g)+D(g)達到平衡后,升高溫度容器內氣體的密度增大。請回答下列問題:
C(g)+D(g)達到平衡后,升高溫度容器內氣體的密度增大。請回答下列問題:
(1)正反應是 (填“放熱”或“吸熱”)反應;該反應的化學平衡常數的表達式是 。
(2)能判斷該反應一定達到平衡狀態的依據是 。(填寫字母編號)
A.體積分數組成C%=D%
B.單位時間內生成n molA的同時生成n molC
C.溫度和體積一定時,某一生成物濃度不再變化
D.溫度和體積一定時,容器內壓強不再變化
(3)該反應的正反應速率隨時間變化的關系如圖所示。t2時改了某種條件,改變的條件是 。(填寫字母編號)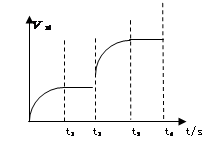
A.升溫 B.加壓 C.催化劑 D.增加A的量
(4)升高溫度到T℃時,在一密閉容器中充入2mol A和3mol B,發生上述反應。平衡后測得K=1。然后在溫度不變的情況下,擴大容器容積至原來的10倍,結果A的百分含量始終未改變,則此時B的轉化率是 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
將一定量的SO2和含0.7mol氧氣的空氣(忽略CO2)放入0.5 L密閉容器內,550℃時,在催化劑作用下發生反應:2SO2(g)+O2(g) 2SO3(g)(正反應放熱)。測得n(O2)隨時間的變化如下表
2SO3(g)(正反應放熱)。測得n(O2)隨時間的變化如下表
| 時間/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(O2)/mol | 0.7 | 0.4 | 0.3 | x | x | x |
查看答案和解析>>
科目:高中化學 來源: 題型:問答題
(18分)堿金屬元素的單質及其化合物被廣泛應用于生產、生活中。
②一定量的Na在足量O2中充分燃燒,參加反應的O2體積為5.6 L(標準狀況),則該反應過程中轉移電子的數目為_________。
(2)金屬鋰廣泛應用于化學電源制造,鋰水電池就是其中的一種產品。該電池以金屬鋰和 鋼板為電極材料,以LiOH為電解質,加入水即可放電。
總反應為:2Li+2H2O=2LiOH+H2↑
①鋰水電池放電時,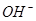 向_________極移動。
向_________極移動。
②寫出該電池放電時正極的電極反應式:_________________。
③電解熔融LiCl可以制備金屬Li。但LiC1熔點在873 K以上,高溫下電解,金屬Li產量極低。經過科學家不斷研究,發現電解LiCl—KCl的熔鹽混合物可以在較低溫度下生成金屬Li。
你認為,熔鹽混合物中KCl的作用是_________________________________________。
寫出電解該熔鹽混合物過程中陽極的電極反應式:______________________________。
(3)最新研究表明,金屬鉀可作工業上天然氣高溫重整的催化劑,有關反應為: 。一定溫度下,向2 L容積不變的密閉容器中充入4 mol
。一定溫度下,向2 L容積不變的密閉容器中充入4 mol 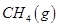 和6 mo1 H2O(g)發生反應,10 min時,反應達到平衡狀態,測得CH4(g)和H2(g)的物質的量隨時間變化的曲線如圖所示。
和6 mo1 H2O(g)發生反應,10 min時,反應達到平衡狀態,測得CH4(g)和H2(g)的物質的量隨時間變化的曲線如圖所示。
①0~10 min內用 (CO)表示的化學反應速率為_________。
(CO)表示的化學反應速率為_________。
②下列敘述中,能夠證明該反應已達到平衡狀態的是_________(填序號)。
a.生成3 molH-H鍵的同時有4 molC-H鍵斷裂
b.其他條件不變時,反應體系的壓強保持不變
c.反應混合氣體的質量保持不變
d.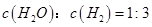
③此溫度下,該反應的化學平衡常數K=_________mo12·L-2。
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
加熱時,N2O5可按下列分解:N2O5 N2O3 + O2,N2O3又可按下列分解: N2O3
N2O3 + O2,N2O3又可按下列分解: N2O3 N2O + O2。今將 4 molN2O5充入一升密閉容器中,加熱至 t℃時反應達到了平衡狀態。平衡時,c(O2)=" 4.5" mol/L, c(N2O3)=" 1.62" mol/L,c(N2O)= mol/L,此時N2O5的分解率為 。
N2O + O2。今將 4 molN2O5充入一升密閉容器中,加熱至 t℃時反應達到了平衡狀態。平衡時,c(O2)=" 4.5" mol/L, c(N2O3)=" 1.62" mol/L,c(N2O)= mol/L,此時N2O5的分解率為 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com