
化學反應原理在工業生產中具有十分重要的意義。
(1)工業生產可以用NH3(g)與CO2(g)經過兩步反應生成尿素,兩步反應的能量變化示意圖如下:
則NH3(g)與CO2(g)反應生成尿素的熱化學方程式為 。
(2)已知反應Fe(s) +CO2(g)  FeO(s) +CO(g) ΔH ="a" kJ/mol
FeO(s) +CO(g) ΔH ="a" kJ/mol
測得在不同溫度下,該反應的平衡常數K隨溫度的變化如下:
①該反應的化學平衡常數表達式K= ,a 0(填“>”、“<”或“=”)。在500℃ 2L密閉容器中進行反應,Fe和CO2的起始量均為4 mol,則5 min后達到平衡時CO2的轉化率為 ,生成CO的平均速率v(CO)為 。
②700℃反應達到平衡后,要使該平衡向右移動,其他條件不變時,可以采取的措施有
(填字母)。
| A.縮小反應器容積 | B.增加Fe的物質的量 |
| C.升高溫度到900℃ | D.使用合適的催化劑 |
(1)2NH3(g)+CO2(g)?H2O(l)+H2NCONH2(s)△H=-134kJ?mol-1;(2)c(CO)/c(CO2);>;50%;0.2mol/(Lmin);C。
解析試題分析:(1)第一步:2NH3(g)+CO2(g)?H2NCOONH4(l,氨基甲酸銨)△H1=-272KJ/mol,第二步:H2NCOONH4(l)?H2O(l)+H2NCONH2(s)△H2=138KJ/mol,根據蓋斯定律,兩個過程相加得到NH3(g)與CO2(g)反應生成尿素的熱化學方程式為2NH3(g)+CO2(g)?H2O(l)+H2NCONH2(s)△H=-134kJ?mol-1;(2)①反應Fe(s)+CO2(g)═FeO(s)+CO(g)的平衡常數k=c(CO)/c(CO2)
,由表中數據可知,對于反應①,溫度越高平衡常數越大,說明升高溫度平衡向正反應移動,升高溫度平衡向吸熱反應進行,故a>0,
令平衡時參加反應的二氧化碳的物質的量為xmol,則:
Fe(s)+CO2(g)═FeO(s)+CO(g)
開始(mol):4 0
變化(mol):x x
平衡(mol):4-x x
所以x/4?x=1解得x=2,故二氧化碳的轉化率為2/4×100%=50%,故CO表示的平均速率v(CO)=2mol
/2L×5min=0.2mol/(L?min)。②A、縮小反應器容積,壓強增大,化學平衡不移動,故A錯誤;B.增加Fe的物質的量,不會引起化學平衡的移動,故B錯誤;C.升高溫度到900℃,化學平衡正向移動,故C正確;D.使用合適的催化劑,不會引起化學平衡的移動,故D錯誤。
考點:化學平衡


科目:高中化學 來源: 題型:填空題
能源的開發、利用與人類社會的可持續發展息息相關,充分利用好能源是擺在人類面前的重大課題。
Ⅰ.已知:①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH=a kJ·mol-1
②CO(g)+l/2O2(g)=CO2(g) ΔH=b kJ·mol-1
③C(石墨)+O2(g)=CO2(g) ΔH=c kJ·mol-1
則反應4Fe(s)+3O2(g)=2Fe2O3(s)的焓變ΔH= kJ·mol-1。
Ⅱ.依據原電池的構成原理,下列化學反應在理論上可以設計成原電池的是 (填序號)。
A.C(s)+CO2(g)=2CO(g) ΔH>0 B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH<0
C.2H2O(l)=2H2(g)+O2(g) ΔH>0 D.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH<0
若以稀硫酸為電解質溶液,則該原電池的正極反應式為 。
Ⅲ.氫氣作為一種綠色能源,對于人類的生存與發展具有十分重要的意義。
(1)實驗測得,在通常情況下,1 g H2完全燃燒生成液態水,放出142.9 kJ熱量。則H2燃燒的熱化學方程式為 。
(2)用氫氣合成氨的熱化學方程式為N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1
2NH3(g) ΔH=-92.4 kJ·mol-1
①一定條件下,下列敘述可以說明該反應已達平衡狀態的是 。
A.υ正(N2)=υ逆(NH3)
B.各物質的物質的量相等
C.混合氣體的物質的量不再變化
D.混合氣體的密度不再變化
②下圖表示合成氨反應達到平衡后,每次只改變溫度、壓強、催化劑中的某一條件,反應速率υ與時間t的關系。其中表示平衡混合物中的NH3的含量最高的一段時間是 。圖中t3時改變的條件可能是 。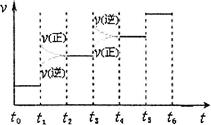
③溫度為T℃時,將4a mol H2和2a mol N2放入0.5 L密閉容器中,充分反應后測得N2的轉化率為50%,則反應的平衡常數為 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
依據事實,寫出下列反應的熱化學反應方程式。
(1)在25℃、101kPa下,1g甲醇完全燃燒生成CO2和液態水時放熱22.68kJ。則表示甲醇燃燒熱的熱化學方程式為 。
(2)若適量的N2和O2完全反應,每生成23gNO2需要吸收16.95kJ熱量,則表示該反應的熱化學方程式為 。
(3)用NA表示阿伏加德羅常數,在C2H2(氣態)完全燃燒生成CO2和液態水的反應中,每有5NA個電子轉移時,放出650kJ的熱量,則表示該反應的熱化學方程式為 _________________________________________________。
(4)已知拆開1molH—H鍵,1molN—H鍵,1molN≡N鍵分別需要的能量是436kJ、391kJ、946kJ,則N2與H2反應生成NH3的熱化學方程式為 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(1)8g液態的CH3OH在氧氣中完全燃燒,生成二氧化碳氣體和液態水時釋放出Q kJ的熱量。試寫出液態CH3OH燃燒熱的熱化學方程式 。
(2)在化學反應過程中,破壞舊化學鍵需要吸收能量,形成新化學鍵又會釋放能量。
| 化學鍵 | H—H | N—H | N≡N |
| 鍵能/kJ·mol-1 | 436 | 391 | 945 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
甲醇是一種很好的燃料,工業上可用多種原料通過不同的反應制得甲醇。
(1)已知在常溫常壓下: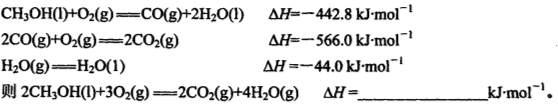
(2)工業上正在研究利用來生產甲醇燃料的方法,該反應為: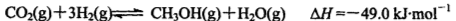
在某溫度下,將6mol CO2和8molH2充入容積為2L的密閉容器中,8分鐘時達平衡狀態,H2的轉化率為75%。請回答:
②用CH3OH表示該反應在0-8min內的平均反應速率v(CH3OH)=____.
②此溫度下該反應平衡常數K=____________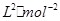 mol;
mol;
③若在上述平衡體系中,再充入2mol H2,反應達到平衡后H2的轉化率____________75% (填“大于”、“小于”或“等于”)。
(3)一氧化碳與氫氣也可以合成甲醇: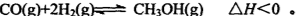
①若該反應在恒溫恒容條件下進行,下列說法正確的是____;
a.若混合氣體的密度不再改變,說明反應已達化學平衡狀態
b.反應達到平衡后,通入CH3OH(g)使壓強增大,平衡向右移動
c.反應達到平衡后,通入氬氣使壓強增大,平衡向右移動
d.反應達到平衡后,升高溫度,平衡逆向移動,平衡常數減小
e.若使用催化劑,會改變反應的途徑,但反應的不變
②某溫度下,在一個容積為2L的密閉容器中進行該反應,已知此溫度下的平衡常數K=50L2/mol2,反應到某時刻測得各組分的物質的量如下:
請比較此時正、逆反應速率的大小: (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
二甲醚(CH3OCH3,沸點為-24.9℃)被稱為21世紀的新型能源。科學家利用太陽能分解水生成的氫氣與從煙道氣中分離出的CO2在催化劑作用下合成二甲醚,并開發出直接以二甲醚為燃料的燃料電池。其合成流程如下:
(1)已知:CH3OCH3(g)、H2(g)的標準燃燒熱分別為:△H= -1455.0kJ·mol-1、△H=" -285.8" kJ·mol-1。寫出以CO2、H2合成CH3OCH3的熱化學方程式: ;
(2)15~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱堿性,上述合成線路中用作CO2吸收劑。寫出吸收CO2反應的化學方程式 ;
(3)一定條件下用CO2和H2合成二甲醚,反應物氣流量對CO2的轉化率、二甲醚的選擇性(是指轉化生成二甲醚的碳占已轉化碳的比例)影響結果如圖1所示,當控制氣流量為28mL· min-1時,則生成0.3mol二甲醚需要通入CO2的物質的量為 ;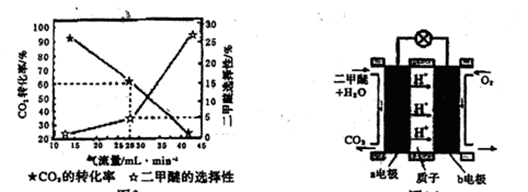
圖1 圖2
(4)圖2為二甲醚燃料電池示意圖。
①a電極的電極反應式為 ;
②若以1.12 L·min-l(標準狀況)的速率向該電池中通入二甲醚,用該電池電解50mL2 mol·L-1 CuSO4溶液,通電0.50 min后,計算理論上可析出金屬銅的質量為 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
據報道,一定條件下由二氧化碳和氫氣合成乙醇已成為現實。
已知:①CH3CH2OH(l) +3 O2 (g) = 2CO2(g) +3H2O(l) △H=-1366.8 kJ/ mol
②2H2 (g) + O2 (g) = 2H2O(l) △H=" -571.6" kJ/ mol
(1)寫出由CO2和H2 反應合成CH3CH2OH (l)和H2O(l)的熱化學方程式 。
(2)堿性乙醇燃料電池易儲存,易推廣,對環境污染小,具有非常廣闊的發展前景。該燃料電池中,使用鉑作電極,KOH溶液做電解質溶液。請寫出該燃料電池負極上的電極反應式為 。
(3)用乙醇燃料電池電解400 mL 飽和食鹽水裝置可簡單表示如下圖: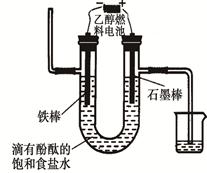
該裝置中發生電解反應的方程式為 ;在鐵棒附近觀察到的現象是 ;當陰極產生448 mL氣體(體積在標準狀況下測得)時,停止電解,將電解后的溶液混合均勻,溶液的pH為 。(不考慮氣體的溶解及溶液體積的變化)
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
Ⅰ、下列實驗操作或對實驗事實的描述正確的是____________________
① 用量筒量取稀硫酸溶液8.0mL;
②中和熱的測定實驗中,可用金屬絲(棒)代替環形攪拌玻璃棒;
③用熱的濃鹽酸洗滌附著有MnO2的試管;
④在硫酸銅晶體結晶水含量的測定中,若加熱后的無水硫酸銅粉末表面發黑,則所測結晶水含量可能會偏高 ;
⑤Fe(OH)3膠體與FeCl3溶液可用過濾的方法分離;
⑥用堿式滴定管量取KMnO4溶液20.50mL ;
⑦將水沿燒杯內壁緩緩注入濃硫酸中,不斷用玻璃棒攪拌以稀釋濃硫酸;
⑧用濕潤的pH試紙測量某溶液pH時,測量值一定比真實值小;
⑨鋅和一定量稀硫酸反應,為加快速率而不影響H2的量可向溶液中加適量Cu(NO3)2晶體。
Ⅱ、2013年初,霧霾天氣多次肆虐天津、北京等地區。其中,燃煤和汽車尾氣是造成空氣污染的原因之一。
(1)汽車尾氣凈化的主要原理為:2NO(g) + 2CO(g) 2CO2(g)+ N2(g)。△H<0
2CO2(g)+ N2(g)。△H<0
①該反應平衡常數表達式
②若該反應在絕熱、恒容的密閉體系中進行,下列示意圖正確且能說明反應在進行到t1時刻達到平衡狀態的是 (填代號)。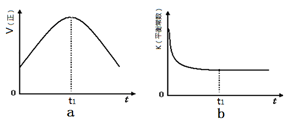
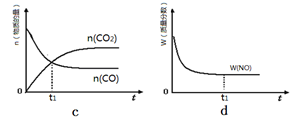
(2)直接排放煤燃燒產生的煙氣會引起嚴重的環境問題。
煤燃燒產生的煙氣含氮的氧化物,用CH4催化還原NOX可以消除氮氧化物的污染。
已知:①CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol
②2NO2(g)  N2O4(g) △H=-56.9 kJ/mol
N2O4(g) △H=-56.9 kJ/mol
③H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
寫出CH4催化還原N2O4(g)生成N2和H2O(l)的熱化學方程式: 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
合成氨反應N2(g)+3H2(g) 2NH3(g),反應過程的能量變化如圖所示。已知N2(g)與H2(g)反應生成17 g NH3(g),放出46.1 kJ的熱量。
2NH3(g),反應過程的能量變化如圖所示。已知N2(g)與H2(g)反應生成17 g NH3(g),放出46.1 kJ的熱量。
請回答下列問題:
(1)該反應通常用鐵作催化劑,加催化劑會使圖中E變_____(填“大”或“小”),E的大小對該反應的反應熱有無影響?_ _。理由是_________ ;
(2)圖中ΔH=________kJ·mol-1;
(3)起始充入2mol·L-1 N2和5.5 mol·L-1 H2,經過50 min,NH3的濃度為1mol·L-1,
則v(N2)=____________mol·L-1·min-1、C(H2)=______________mol·L-1;
已知NH3(g)= NH3 (l) ΔH=-QkJ·mol-1,書寫N2(g)+3H2(g)=2NH3 (l)的熱化學方程式 ________ 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com