
【題目】實驗室用濃鹽酸和![]() 制
制![]() ,并以干燥的
,并以干燥的![]() 為原料進行實驗,裝置如下圖所示。
為原料進行實驗,裝置如下圖所示。
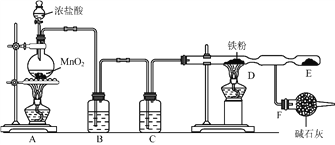
⑴裝置![]() 燒瓶中發生反應的化學方程式為:_________________________________。
燒瓶中發生反應的化學方程式為:_________________________________。
⑵裝置![]() 、
、![]() 中應盛放的試劑名稱分別為__________、_________;從
中應盛放的試劑名稱分別為__________、_________;從![]() 裝置導出的氣體若不經過
裝置導出的氣體若不經過![]() 、
、![]() 裝置而直接進入
裝置而直接進入![]() 管,將對實驗產生的不良后果是___________________________。
管,將對實驗產生的不良后果是___________________________。
⑶實驗時,先點燃![]() 處的酒精燈,讓氯氣充滿裝置,再點燃
處的酒精燈,讓氯氣充滿裝置,再點燃![]() 處酒精燈,寫出
處酒精燈,寫出![]() 中反應的化學方程式:_________________________________________。
中反應的化學方程式:_________________________________________。
⑷![]() 裝置所起的作用是____________________,____________________。
裝置所起的作用是____________________,____________________。
⑸用廉價的石灰乳吸收氯氣可制得漂粉精,寫出工業制漂粉精反應的化學方程式:
___________________________________________________________________。
【答案】 MnO2+4HCl(濃) → MnCl2+Cl2 ↑ +2H2O 飽和食鹽水 濃硫酸 鐵粉會與氯化氫、水反應生成氫氣,易發生爆炸,防止生成氯化亞鐵。(答案合理就給分) 2Fe+3Cl2 → 2FeCl3 吸收未反應的氯氣,以免污染空氣 防止空氣中的水蒸氣進入E中 2Cl2+2Ca(OH)2 → CaCl2+Ca(ClO)2+2H2O
【解析】(1)A裝置燒瓶中發生制備氯氣的反應,反應的化學方程式為MnO2+4HCl(濃) ![]() MnCl2+Cl2 ↑+2H2O。(2)生成的氯氣中含有氯化氫和水蒸氣,與鐵反應時需要凈化氯氣,因此裝置B、C中應盛放的試劑名稱分別為飽和食鹽水、濃硫酸;鐵是活潑的金屬,能與鹽酸、水蒸氣反應生成可燃性氣體氫氣,因此從A裝置導出的氣體若不經過B、C裝置而直接進入D管,將對實驗產生的不良后果是鐵粉會與氯化氫、水反應生成氫氣,易發生爆炸,防止生成氯化亞鐵。(3)加熱時鐵和氯氣化合生成氯化鐵,反應的化學方程式為2Fe+3Cl2
MnCl2+Cl2 ↑+2H2O。(2)生成的氯氣中含有氯化氫和水蒸氣,與鐵反應時需要凈化氯氣,因此裝置B、C中應盛放的試劑名稱分別為飽和食鹽水、濃硫酸;鐵是活潑的金屬,能與鹽酸、水蒸氣反應生成可燃性氣體氫氣,因此從A裝置導出的氣體若不經過B、C裝置而直接進入D管,將對實驗產生的不良后果是鐵粉會與氯化氫、水反應生成氫氣,易發生爆炸,防止生成氯化亞鐵。(3)加熱時鐵和氯氣化合生成氯化鐵,反應的化學方程式為2Fe+3Cl2 ![]() 2FeCl3。(4)氯氣是大氣污染物,因此裝置F所起的作用是吸收未反應的氯氣,以免污染空氣,同時還防止空氣中的水蒸氣進入E中。(5)石灰乳和氯氣反應制漂粉精的化學方程式為2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。
2FeCl3。(4)氯氣是大氣污染物,因此裝置F所起的作用是吸收未反應的氯氣,以免污染空氣,同時還防止空氣中的水蒸氣進入E中。(5)石灰乳和氯氣反應制漂粉精的化學方程式為2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】甲苯(![]() )是一種重要的化工原料,能用于生產苯甲醛(
)是一種重要的化工原料,能用于生產苯甲醛(![]() )、苯甲酸(
)、苯甲酸(![]() )等產品。表列出了有關物質的部分物理性質,請回答:
)等產品。表列出了有關物質的部分物理性質,請回答:
名稱 | 性狀 | 熔點(℃) | 沸點(℃) | 相對密度 (ρ水=1g/cm3) | 溶解性 | |
水 | 乙醇 | |||||
甲苯 | 無色液體易燃易揮發 | -95 | 110.6 | 0.8660 | 不溶 | 互溶 |
苯甲醛 | 無色液體 | -26 | 179 | 1.0440 | 微溶 | 互溶 |
苯甲酸 | 白色片狀或針狀晶體 | 122.1 | 249 | 1.2659 | 微溶 | 易溶 |
注:甲苯、苯甲醛、苯甲酸三者互溶。
實驗室可用如圖裝置模擬制備苯甲醛。實驗時先在三頸瓶中加入0.5g固態難溶性催化劑,再加入15mL冰醋酸(作為溶劑)和2mL甲苯,攪拌升溫至70℃,同時緩慢加入12mL過氧化氫,在此溫度下攪拌反應3小時。
 (1)裝置a的名稱是______________。
(1)裝置a的名稱是______________。
(2)三頸瓶中發生反應的化學方程式為_______________________________________。
(3)經測定,反應溫度升高時,甲苯的轉化率逐漸增大,但溫度過高時,苯甲醛的產量卻有所減少,可能的原因是_____________________________________________。
(4)反應完畢后,反應混合液經過自然冷卻至室溫時,還應經過_____、_____(填操作名稱)等操作,才能得到苯甲醛粗產品。
(5)實驗中加入過量過氧化氫且反應時間較長,會使苯甲醛產品中產生較多的苯甲酸。
①若想從混有苯甲酸的苯甲醛中分離出苯甲酸,正確的操作步驟是_______(按步驟順序填字母)。
a.對混合液進行分液 b.過濾、洗滌、干燥
c.水層中加入鹽酸調節pH=2 d.加入適量碳酸氫鈉溶液混合振蕩
②若對實驗①中獲得的苯甲酸產品進行純度測定,可稱取2.500g產品,溶于200mL乙醇配成溶液,量取所得的乙醇溶液20.00mL于錐形瓶,滴加2~3滴酚酞指示劑,然后用預先配好的0.1000mol/L KOH標準液滴定,到達滴定終點時消耗KOH溶液18.00mL。產品中苯甲酸的質量分數為_____。(苯甲酸相對分子質量:122.0)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】合成氨是人類科學技術發展史上的一項重大突破,研究表明液氨是一種良好的儲氫物質。
(1)N2(g)+3H2(g)2NH3(g) △H<0,研究表明金屬催化劑可加速氨氣的合成。下表為某溫度下等質量的不同金屬分別催化合成氨氣時,氫氣的初始速率(mmol min-1)。
催化劑 | Ru | Rh | Ni | Pt | Pd | Fe |
初始速率 | 7.9 | 4.0 | 3.0 | 2.2 | 1.8 | 0.5 |
①不同催化劑存在下,合成氨氣反應的活化能最大的是_______ (填寫催化劑的化學式)。
②某研究小組進一步探究催化劑對合成氨氣的影響。將N2和H2以一定的流速通過兩種不同的催化劑進行反應,相同時間內測量逸出氣體中NH3含量,如下圖,從而確定溫度對催化劑的影響。a點___ (填“是”或“不是”)對應溫度下氨氣平衡時的百分含量,說明其理由___。

(2)氨氣的分解反應2NH3N2+3H2 △H<0,,在實際生產中往剛性容器中同時通入氨氣和水蒸氣,測得容器總壓和氨氣轉化率隨時間變化結果如圖所示。
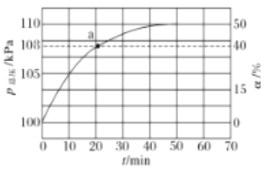
①平衡時,p(H2O)= ___kPa,平衡常數Kp=_____KPa2(Kp為以分壓表示的平衡常數)。
②反應速率v=v正-v逆=K正p2(NH3)-K逆p(N2)p3(H2),k正、k逆分別為正、逆反應速率常數。計算a處的![]() =__。
=__。
(3)液氨中,2NH3(l)NH2-+NH4+,用Pt電極對液氨進行電解也可產生H2和N2。陰極的電極反應______。
(4)在室溫下用氨水吸收SO2。將含SO2的煙氣通入該氨水中,當溶液顯中性時,溶液中的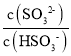 =____。(已知25℃,Kb(NH3H2O)=1.810-5;Ka1(H2SO3)=.310-2,Ka2(H2SO3)=6.210-8)
=____。(已知25℃,Kb(NH3H2O)=1.810-5;Ka1(H2SO3)=.310-2,Ka2(H2SO3)=6.210-8)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是病人輸液用的葡萄糖(分子式為C6H12O6)注射液的標簽上的部分內容。據標簽所提供的信息,以下說法錯誤的是( )
5%葡萄糖注射液
500 mL
(性狀)本品為無色或幾乎為無色的透明液體
(規格)500 mL 25 g
(貯藏)密封保存
A. 該注射液中葡萄糖的質量分數是5%
B. 葡萄糖的摩爾質量為180 g·mol-1
C. 該注射液的密度約為1g·cm-3
D. 該注射液中葡萄糖的物質的量濃度約為0.014mol·L-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在花瓶中加入“鮮花保鮮劑”,能延長鮮花的壽命。下表是500mL“鮮花保鮮劑”中含有的成分,閱讀后回答下列問題:
成分 | 質量(g) | 摩爾質量(g/mol) |
蔗糖 | 50.00 | 342 |
硫酸鉀 | 0.87 | 174 |
阿司匹林 | 0.35 | 180 |
高錳酸鉀 | 0.158 | 158 |
硝酸銀 | 0.04 | 170 |
(1)下列“鮮花保鮮劑”的成分中,屬于非電解質的是__________。
A.蔗糖 B.硫酸鉀 C.高錳酸鉀 D.硝酸
(2)在溶液配制過程中,下列操作正確且對配制結果沒有影響的是__________。
A.將藥品放入容量瓶中加蒸餾水溶解
B.容量瓶在使用前未干燥,里面有少量蒸餾水
C.容量瓶在使用前剛剛配制完一定物質的量濃度的NaCl溶液而未洗凈
D.定容搖勻后發現液面低于容量瓶的刻度線,但未做任何處理
(3)配制上述500mL“鮮花保鮮劑”所需的玻璃儀器有:燒杯、玻璃棒、_____________、__________。(在橫線上填寫所缺儀器的名稱)
(4)鮮花保鮮劑中K+(蔗糖、阿司匹林中不含K+) 的物質的量濃度為______mol/L。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】通過以下反應可獲得新型能源二甲醚(![]() )。下列說法不正確的是
)。下列說法不正確的是
①![]()
![]()
②![]()
![]()
③![]()
![]()
④![]()
![]()
A. 反應①、②為反應③提供原料氣
B. 反應③也是![]() 資源化利用的方法之一
資源化利用的方法之一
C. 反應![]() 的
的![]()
D. 反應![]() 的
的![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氫氣是一種清潔能源,氫氣的制取、儲存一直是氫能源利用領域的研究熱點。
(1)工業上制取![]() 有多種方法,如:
有多種方法,如:
①![]()
②![]()
③![]()
甲烷和水蒸氣催化重整制高純氫時,初始反應的生成物為![]() 和
和![]() ,其物質的量之比為4:1,則該反應的熱化學方程式為________。
,其物質的量之比為4:1,則該反應的熱化學方程式為________。
(2)鑭鎳合金是一種良好的儲氫材料,向體積恒定的密閉容器中充入氫氣發生如下反應:![]() 。
。![]() 的平衡轉化率與其初始充入物質的量
的平衡轉化率與其初始充入物質的量![]() 、反應溫度
、反應溫度![]() 的關系如左圖所示;一定溫度下,容器內的壓強
的關系如左圖所示;一定溫度下,容器內的壓強![]() 隨時間
隨時間![]() 的變化關系如右圖所示。
的變化關系如右圖所示。
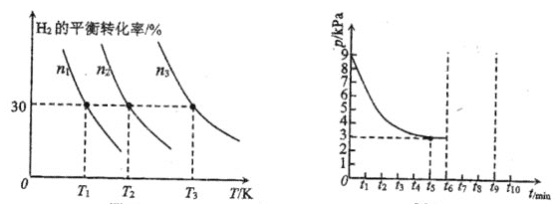
①左圖中![]() 初始充入量由大到小的是________。
初始充入量由大到小的是________。
②該反應平衡常數的大小關系為![]() ________
________![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() ,理由是________。
,理由是________。
③若保持溫度不變,在![]() 時刻將容器的容積壓縮至原來的一半,并在
時刻將容器的容積壓縮至原來的一半,并在![]() 時刻達到平衡。請在右圖中畫出相應的變化曲線______。
時刻達到平衡。請在右圖中畫出相應的變化曲線______。
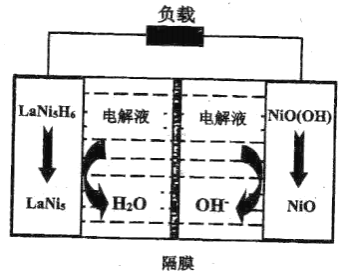
④某二次鎳氫電池放電時的工作原理如圖所示,其中隔膜為________離子交換膜![]() 填“陰”或“陽”
填“陰”或“陽”![]() ,負極的電極反應式為________。
,負極的電極反應式為________。
(3)儲氫還可以借助有機物,如利用環己烷和苯之間的可逆反應來實現脫氫和加氫:
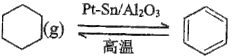
![]() 。在某溫度下,向容積為2L的恒容容器中加入
。在某溫度下,向容積為2L的恒容容器中加入![]() 環己烷,平衡時體系中壓強為
環己烷,平衡時體系中壓強為![]() ,苯的物質的量為
,苯的物質的量為![]() ,則平衡常數
,則平衡常數![]() ________
________![]() 用含a、b、p的代數式表示;用平衡分壓代替平衡濃度計算,分壓
用含a、b、p的代數式表示;用平衡分壓代替平衡濃度計算,分壓![]() 總壓
總壓![]() 物質的量分數
物質的量分數![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學興趣小組用稀硫酸和高純度鋅粒按如圖所示裝置制取H2并還原CuO時,發現尾氣略有刺激性。通過進一步探究,證明尾氣中含有SO2。
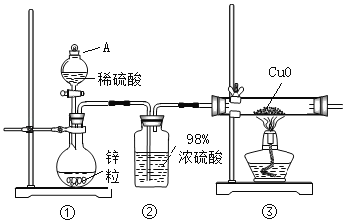
(1)A裝置的名稱_____;②裝置中濃硫酸的作用_____;
(2)經討論,認為SO2的產生有以下兩種可能:
甲同學:_____反應產生了SO2;
乙同學:H2與②裝置中濃硫酸反應產生了SO2;
請完善甲同學的猜想,并結合供選試劑設計簡單方案求證乙同學猜想的合理性。(儀器任選;除上述試劑外,可另選試劑如下:稀鹽酸、稀硝酸、無水氯化鈣、堿石灰)________________________
(3)如果乙同學猜想成立,請用化學方程式表示其原理_____;
(4)已知常溫下H2不能與酸性高錳酸鉀溶液反應,有同學提出可以在②裝置前用酸性高錳酸鉀溶液除去SO2,請用離子方程式表示反應的原理:_____;
(5)SO2是一種有毒的污染性氣體,實驗室常用X溶液進行尾氣處理,X是_____(填化學式);尾氣吸收時下列裝置不能起到防倒吸效果的是_____(填選項)。
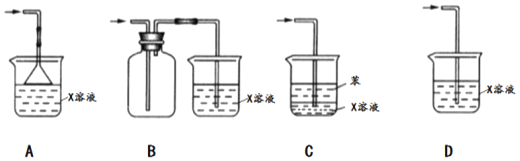
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學反應速率是化學反應原理的重要組成部分。請回答下列問題:
(1)已知一定條件下發生反應:2SO2(g)+O2(g)![]() 2SO3(g)ΔH<0,在反應過程中,正反應速率的變化如圖所示,請根據速率的變化回答采取的措施(改變的條件)。
2SO3(g)ΔH<0,在反應過程中,正反應速率的變化如圖所示,請根據速率的變化回答采取的措施(改變的條件)。
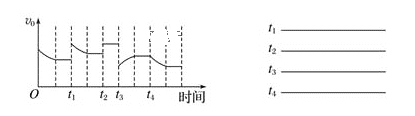
_______、________、_______、______
(2)探究反應條件對0.l0 mol·L-1Na2S2O3溶液與稀H2SO4反應速率的影響。其設計與測定結果如表:
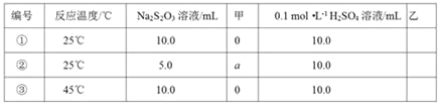
上述實驗①③是探究____對化學反應速率的影響;若上述實驗①②是探究濃度對化學反應速率的影響,則表格中“甲”為____,a為____;乙是實驗需要測量的物理量,則表格中“乙”為____。
(3)已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在開始一段時間內,反應速率較小,溶液褪色不明顯;但不久突然褪色,反應速率明顯增大。
①針對上述現象,某同學認為該反應放熱,導致溶液溫度上升,反應速率增大。從影響化學反應速率的因素看,你猜想還可能是___的影響。
②若用實驗證明你的猜想,除酸性高錳酸鉀溶液、草酸溶液外,可以在反應一開始時加入____(填字母)。
A.硫酸鉀 B.氯化錳 C.硫酸錳 D.水
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com