
利用酸解法制鈦白粉產生的廢液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4],生產鐵紅和補血劑乳酸亞鐵。其生產步驟如下: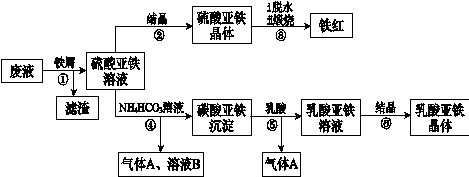
已知:TiOSO4可溶于水,在水中可以電離為TiO2+和SO42—。請回答:
(1)步驟①中分離硫酸亞鐵溶液和濾渣的操作中所用的玻璃儀器是 。
步驟②得到硫酸亞鐵晶體的操作為蒸發濃縮、 。
(1)步驟④的離子方程式是 。
(1)步驟⑥必須控制一定的真空度,原因是有利于蒸發水以及 。
(1)硫酸亞鐵在空氣中煅燒生成鐵紅和三氧化硫,該反應中氧化劑和還原劑的物質的量之比為 。
(1)用平衡移動的原理解釋步驟⑤中加乳酸能得到乳酸亞鐵的原因 。
(1)為測定步驟②中所得晶體中FeSO4·7H2O的質量分數,取晶體樣品a g,溶于稀硫酸配成100.00 mL溶液,取出20.00 mL溶液,用KMnO4溶液滴定(雜質與KMnO4不反應)。若消耗0.1000 mol?L-1 KMnO4溶液20.00 mL,所得晶體中FeSO4·7H2O的質量分數為(用a表示) 。
(1)玻璃棒、燒杯、漏斗 (1分) ;冷卻結晶、過濾、洗滌、干燥(1分)
(1)Fe2++2HCO3-=FeCO3↓+H2O+CO2↑(2分)
(1)防止Fe2+被氧化(1分)
(1)1: 4 (2分)
(1)FeCO3(s)  Fe2+(aq)+ CO32-(aq) CO32-與乳酸反應濃度降低,平衡向右移動,使碳酸亞鐵溶解得到乳酸亞鐵溶液(2分)
Fe2+(aq)+ CO32-(aq) CO32-與乳酸反應濃度降低,平衡向右移動,使碳酸亞鐵溶解得到乳酸亞鐵溶液(2分)
(1)13.9/a ×100%(2分)
解析試題分析:
(1)過濾用的儀器:玻璃棒、燒杯、漏斗 ;“冷卻結晶、過濾、洗滌、干燥”從溶液變成純固體。
“冷卻結晶、過濾、洗滌、干燥”從溶液變成純固體。
(2)Fe2++2HCO3-→FeCO3↓+H2O+CO2↑
(3)隔絕空氣,防止Fe2+被氧化 。
(4)4FeSO4+ O2 =4SO3 + 2 Fe2O3 氧化劑O2和還原劑FeSO4的物質的量之比 1: 4 。
(6)FeSO4和KMnO4反應的關系式 解:設20.00 mL溶液含FeSO4的物質的量為x
10FeSO4·7H2O ——2 KMnO4
2
x 0.1000*20.00/1000 x=0.01
100 mL FeSO4·7H2O的物質的量為0.01*5=0.05 (mol)
FeSO4·7H2O的質量分數為278*0.05*100%/a=13.9/a ×100%
考點:本題以化學實驗為基礎,考查實驗設計、實驗操作、分析和化學計算等知識。


科目:高中化學 來源: 題型:填空題
據新華社報道,發展改革委員會于2007年4月發出“遏制鋁冶煉投資反彈”的緊急通知。原因是鋁冶煉屬高耗能產業,而且某些鋁冶煉企業以污染環境為代價,得不償失。
如圖是傳統的工業生產金屬鋁的基本流程圖,閱讀上述新聞信息,結合鋁生產的流程圖解答下列問題: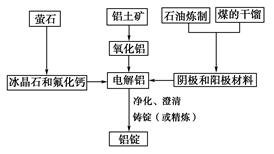
請回答:
(1)工業冶煉金屬鋁用的是鋁土礦,鋁土礦的主要成分是________(填化學式)。石油煉制和煤的干餾產品____________(填物質名稱)作電解鋁的陰極和陽極材料。
(2)氧化鋁熔點高達2050 ℃,工業上為了降低能量消耗,在金屬鋁的冶煉中采取的措施是__________________________。
(3)在冶煉過程中,陽極材料需要定期地進行更換,原因是該極材料不斷被消耗,產生這種現象的原因是:__________________________________________(用化學方程式表示)。
(4)工業上制取金屬鎂時是電解MgCl2,電解反應方程式為_________________,鎂和鋁都是活潑金屬,為什么在電解冶煉過程中,一個用氯化物,一個用氧化物?原因是:
_________________________________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
金屬鈦(Ti)因其硬度大、熔點高、常溫時耐酸堿腐蝕而被廣泛用作高新科技材料,被譽為“未來金屬”。以鈦鐵礦(主要成分FeTiO3,鈦酸亞鐵)為主要原料冶煉金屬鈦同時獲得副產品甲的工業生產流程如下,回答下列問題:
(1)鈦鐵礦和濃硫酸反應的產物之一是TiOSO4,反應中無氣體生成。副產品甲俗稱“綠礬”其化學式是________________。
(2)上述生產流程中加入Fe屑的目的是 (用離子方程式表示),檢驗副產品甲是否變質的實驗方法是 。
(3)上述生產流程中所得到的金屬鈦中混有少量雜質,可加入 溶解后除去。
(4)溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等陽離子。常溫下,其對應氫氧化物的Ksp如下表所示。
| 氫氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
| Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |

查看答案和解析>>
科目:高中化學 來源: 題型:
硫酸亞錫(SnSO4)可用于鍍錫工業.某小組設計SnSO4制備路線為: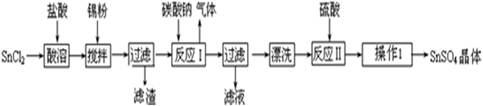
查閱資料:
Ⅰ.酸性條件下,錫在水溶液中有Sn2+、Sn4+兩種主要存在形式,Sn2+易被氧化.
Ⅱ.SnCl2易水解生成堿式氯化亞錫
(1)錫原子的核電荷數為50,與碳元素同處ⅣA族,錫位于周期表的第 周期(1分)
(2)操作Ⅰ是 過濾、洗滌等(2分)
(3)溶解SnCl2粉末需加濃鹽酸,原因是
(4)加入Sn粉的作用有兩個:①調節溶液pH ②
(5)反應Ⅰ得到沉淀是SnO,得到該沉淀的離子反應方程式是
(6)酸性條件下,SnSO4與雙氧水去反應的離子方程式是
(7)該小組通過下列方法測定所用錫粉的純度(雜質不參與反應):
①將試樣溶于鹽酸中,發生的反應為:Sn+2HCl═SnCl2+H2↑;
②加入過量的FeCl3;
③用已知濃度的K2Cr2O7滴定②生成的Fe2+,再計算錫粉的純度,請配平方程式:
FeCl2 + K2Cr2O7 + HCl = FeCl3 + KCl + CrCl2+ 
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
二氧化鈦廣泛應用于各類結構表面涂料、紙張涂層等,二氧化鈦還可作為制備鈦單質的原料。
Ⅰ.二氧化鈦可由以下兩種方法制備:
方法1:TiCl4水解生成TiO2·xH2O,過濾、水洗除去其中的Cl-,再烘干、焙燒除去水分得到粉體TiO2,此方法制備得到的是納米二氧化鈦。
(1)① TiCl4水解生成TiO2·x H2O的化學方程式為_______________________________;
② 檢驗TiO2·x H2O中Cl-是否被除凈的方法是______________________________。
方法2:可用含有Fe2O3的鈦鐵礦(主要成分為FeTiO3,其中Ti元素化合價為+4價)制取,其主要流程如下:
(2)Fe2O3與H2SO4反應的離子方程式是 。
(3)甲溶液中除含TiO2+之外還含有的金屬陽離子有 。
(4)加Fe的作用是 。
Ⅱ.二氧化鈦可用于制取鈦單質
(5)TiO2制取單質Ti,涉及到的步驟如下:
反應②的方程式是 ,該反應需要在Ar氣氛中進行,請解釋原因:_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
元素鍶(Sr)位于周期表第5周期第IIA族。碳酸鍶(SrCO3)被廣泛用于彩色電視機的陰極射線管。以天青石(主要成分為SrSO4,含不溶性雜質)為原料制取高純碳酸鍶的“煅燒浸取法”部分工藝流程示意如下。
(1)寫出與元素鍶同族第3周期元素的原子結構示意圖: 。
(2)隔絕空氣高溫焙燒中,若0.5mol SrSO4中只有S被還原,轉移了4mol電子。寫出該反應的化學方程式: 。
(3)制取高純碳酸鍶過程中,常用乙醇胺(HOCH2CH2NH2)作為CO2吸收劑。乙醇胺水溶液顯弱堿性(與NH3溶于水原理相似),原因是 (用離子方程式表示)。
(4)該流程中過濾2之后還有除雜等多步操作,其中最后兩步是 。
(5)“低溫濕法”是一種制取碳酸鍶的方法:將天青石粉末與碳酸鈉溶液混合,70oC下加熱1~2h后,經一系列操作,得到碳酸鍶。主要反應為: SrSO4(s)+CO
SrSO4(s)+CO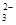 (aq) SrCO3(s)+SO
(aq) SrCO3(s)+SO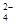 (aq)
(aq)
[已知:70oC時,Ksp(SrSO4)=3.3×10-7,Ksq(SrCO3)=1.1×10-10]
上述反應的平衡常數K= 。
(6)通過“低溫濕法”得到的碳酸鍶純度較低,可能的原因是 (寫一種)。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
電鍍污泥中含有Cr(OH)3、Al2O3、ZnO、CuO、NiO等物質,工業上通過“中溫焙燒—鈉氧化法”回收Na2Cr2O7等物質。
已知:水浸后溶液中存在Na2CrO4、NaAlO2、Na2ZnO2等物質
(1)水浸后的溶液呈____性(“酸”、“堿”、“中”)。
(2)完成氧化焙燒過程中生成Na2CrO4的化學方程式:
____Cr(OH)3+____Na2CO3+_____  = ____Na2CrO4+___CO2+_____
= ____Na2CrO4+___CO2+_____
(3)濾渣II的主要成分有Zn(OH)2、___________________________________。
(4)“系列操作”中為:繼續加入H2SO4,________冷卻結晶,過濾。繼續加入H2SO4目的是________________________。
已知:①除去濾渣II后,溶液中存在如下反應:2CrO42ˉ+2H+ Cr2O72ˉ+H2O
Cr2O72ˉ+H2O
②Na2Cr2O7、Na2CrO4在不同溫度下的溶解度如下表
| 溫度 化學式 | 20℃ | 60℃ | 100℃ |
| Na2SO4 | 19.5 | 45.3 | 42.5 |
| Na2Cr2O7 | 183 | 269 | 415 |
| Na2CrO4 | 84 | 115 | 126 |
查看答案和解析>>
科目:高中化學 來源: 題型:問答題
某化學小組在實驗室模擬用軟錳礦(主要成分MnO2,雜質為鐵及銅的化合物等)制備高純碳酸錳,過程如下(部分操作和條件略):
① 緩慢向燒瓶中(見圖)通入過量混合氣進行“浸錳”操作,主要反應原理為: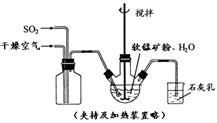
SO2+ H2O = H2SO3
MnO2+ H2SO3 = MnSO4+ H2O
(鐵浸出后,過量的SO2 會將Fe3+還原為Fe2+)
② 向“浸錳”結束后的燒瓶中加入一定量純MnO2粉末。
③ 再用Na2CO3溶液調節pH為3.5左右,過濾。
④ 調節濾液pH為6.5~7.2 ,加入NH4HCO3 ,有淺紅色的沉淀生成,過濾、洗滌、干燥,得到高純碳酸錳。
回答:
(1)“浸錳”反應中往往有副產物MnS2O6 的生成,溫度對“浸錳”反應的影響如下圖,為減少MnS2O6的生成,“浸錳”的適宜溫度是 。
(2)查閱表1,③中調pH為3.5時沉淀的主要成分是 。②中加入一定量純MnO2粉末的主要作用是 ,相應反應的離子方程式為 。
表1:生成相應氫氧化物的pH
| 物質 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 |
| 開始沉淀pH | 2.7 | 7.6 | 8.3 | 4.7 |
| 完全沉淀pH | 3.7 | 9.6 | 9.8 | 6.7 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
某工廠用CaSO4、H2O、NH3、CO2制備(NH4)2SO4。其工藝流程如下:
下列推斷不合理的是 ( )。
| A.往甲中通CO2有利于(NH4)2SO4生成 |
| B.生成1 mol(NH4)2SO4至少消耗2 mol NH3 |
| C.在實際生產中CO2可被循環使用 |
| D.直接蒸干濾液能得到純凈的(NH4)2SO4 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com