
高鐵酸鉀(K2FeO4)是一種新型、高效、多功能綠色水處理劑,比C12、O2、C1O2、KMnO4氧化性更強,無二次污染,工業上是先制得高鐵酸鈉,然后在低溫下,向高鐵酸鈉溶液中加入KOH至飽和,使高鐵酸鉀析出。
(1)干法制備高鐵酸鉀的主要反應為:
2FeSO4 + 6Na2O2= 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑
①該反應中的氧化劑是 ,還原劑是 ,每生成l molNa2FeO4轉移 mol電子。
②簡要說明K2FeO4作為水處理劑時所起的作用 ,
。
(2)濕法制備高鐵酸鉀(K2FeO4)的反應體系中有六種數粒:Fe(OH)3、C1O-、OH-、FeO42-、C1-、H2O。
①寫出并配平濕法制高鐵酸鉀的離子反應方程式: 。
②每生成1mol FeO42- 轉移 mo1電子,若反應過程中轉移了0.3mo1電子,則還原產物的物質的量為 mo1。
③低溫下,在高鐵酸鈉溶液中加入KOH至飽和可析出高鐵酸鉀(K2FeO4),說明什么問題 。
(1)①Na2O2; Na2O2和FeSO4;5
②高鐵酸鉀具有強氧化性,能殺菌消毒;消毒過程中自身被還原為Fe3+,Fe3+水解生成Fe(OH)3膠體能吸附水中懸浮雜質而沉降。
(2)①2Fe(OH)3+3ClO?+4OH?=2FeO42?+3Cl?+5H2O
②3;0.15mol
③該溫度下K2FeO4比Na2FeO4的溶解度小。
解析試題分析:(1)①6Na2O2中,10個O由-1價降低為-2價,所以Na2O2為氧化劑;FeSO4中的Fe由+2價升高為+6價,6Na2O2中,2個O由-1價升高為0,故Na2O2和FeSO4為還原劑;生成l molNa2FeO4時,5molO由-1價降低為-2價,轉移電子5mol。②全面考慮問題,既要考慮到K2FeO4具有強氧化性,還要考慮產物Fe3+的性質。
(2)①C1O-把Fe(OH)3氧化為FeO42?,Cl降價為Cl?,根據元素組成,反應物有OH?,產物中有H2O,配平可得離子方程式。②Fe由+6價將為+3價,所以每生成1mol FeO42- 轉移3mol電子;根據化合價的變化和方程式可知:Cl?~2e?,轉移0.3mo1電子時,還原產物Cl?為0.15mol。
③根據沉淀溶解平衡,在溶液中,溶解度小的物質先析出。
考點:本題考查氧化劑還原劑的判斷、電子轉移及計算、離子方程式的書寫、沉淀溶解平衡。


科目:高中化學 來源: 題型:填空題
(1)用甲烷制氫是一種廉價的制氫方法。有關的熱化學方程式如下:
CH4(g)+1/2O2(g)  CO(g)+2H2(g);△H= -36kJ/mol……… ①
CO(g)+2H2(g);△H= -36kJ/mol……… ①
CH4(g)+H2O(g)  CO(g)+3H2(g);△H= +216kJ/mol…………②
CO(g)+3H2(g);△H= +216kJ/mol…………②
①下列說法正確的是 ____
| A.2H2O(l)=2H2(g)+O2(g) △H=+504kJ/mol |
| B.當反應①中υ(CH4)正=υ(CO)正時,表明該反應達平衡狀態 |
| C.其它條件不變時,增大體系壓強,反應①②中甲烷的轉化率均增大 |
| D.為維持恒定溫度(不考慮熱量損失),某反應器中同時發生反應①與②時,消耗甲 |
 CO(g)+3H2(g)。當甲烷的轉化率為0.5時,此時平衡常數為 _______
CO(g)+3H2(g)。當甲烷的轉化率為0.5時,此時平衡常數為 _______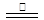 3Na2FeO2+H2O+NH3↑…………①;
3Na2FeO2+H2O+NH3↑…………①;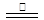 4Na2Fe2O4+3NH3↑……②;
4Na2Fe2O4+3NH3↑……②;查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(1)用“單線橋”表示下列反應電子轉移的方向和數目:2KMnO4 + 16HCl=" 2KCl" + 2MnCl2 + 5Cl2↑+ 8H2O 反應中物質的氧化性:KMnO4_____ Cl2(填“>、<、=”);氧化產物與還原產物的物質的量之比為_____________。
(2)配平下列氧化還原反應方程式:___KMnO4+___H2S+__H2SO4(稀) —— __K2SO4+__MnSO4+__S↓+__H2O
(3)Cl2是一種黃綠色有毒氣體,化工廠可用濃氨水來檢驗有毒氣體Cl2是否泄漏,有關反應的化學方程式為:3Cl2+8NH3=6NH4Cl +N2若反應中NH3消耗6.8 g,則轉移電子個數為 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
已知: NO3-+4H++3e-→NO+2H2O 。現有四種物質:KMnO4、Na2CO3、Cu2O、Fe2(SO4)3,其中能使上述還原過程發生的是 (填化學式),寫出該反應化學方程式中氧化產物的化學計量數(寫方框內)及其化學式□ 。1mol該物質與某濃度硝酸反應時,被還原硝酸的物質的量增加,原因是: 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
重鉻酸鈉俗稱紅礬鈉(Na2Cr2O7·2H2O)是重要的化工產品和強氧化劑。工業上通過煅燒鉻鐵礦制取,其反應如下:
反應Ⅰ 4Fe(CrO2)2+8Na2CO3+7O2 → 2Fe2O3+8Na2CrO4+8CO2
反應Ⅱ 2CrO42- + 2H+ → Cr2O72- + H2O
反應Ⅲ 3CrO42- + 4H+ →Cr3O102- + 2H2O(副反應)
(1)上述反應中不屬于氧化還原反應有 個。已知Fe(CrO2)2中鉻元素是+3價,關于反應Ⅰ的下列說法中正確的是 。
a.被氧化的元素只有+3的Cr,被還原的元素只有0價的O
b.氧化劑與還原劑的物質的量之比為4:7
c.每生成1molCO2,轉移3.5mol電子
d.每摩爾+3的Cr能還原0.75mol氧氣
(2)+6價鉻的毒性很強,制取紅礬鈉后的廢水中含有的Cr2O72-,可以用綠礬除去。測得反應后的溶液中含Cr3+、Fe2+、Fe3+、H+等陽離子。寫出該反應的離子方程式并標出電子轉移的方向和數目: 。
(3)某廠廢水中含1.00×10?3mol/L的Cr2O72-,其毒性較大。某研究性學習小組為了變廢為寶,將廢水處理得到磁性材料Cr0.5Fe1.5FeO4 (Cr的化合價為+3,Fe的化合價依次為+3、+2)。欲使1L該廢水中的Cr2O72-完全轉化為Cr0.5Fe1.5FeO4。理論上需要加入 g FeSO4·7H2O。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
利用化學原理對工廠排放的廢水、廢渣等進行有效檢測與合理處理。
(一)染料工業排放的廢水中含有大量有毒的NO2-,可以在堿性條件下加入鋁粉除去(加熱處理后的廢水會產生能使濕潤的紅色石蕊試紙變藍的氣體)。除去NO2-的離子方程式為________。
(二)某工廠對制革工業污泥中Cr(Ⅲ)回收與再利用工藝如下(硫酸浸取液中金屬離子主要是Cr3+,其次是Fe3+、Fe2+、Al3+、Ca2+、Mg2+):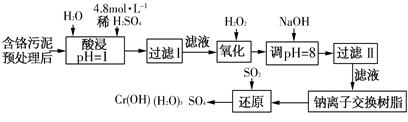
常溫下部分陽離子以氫氧化物形式沉淀時溶液的pH見下表:
| 陽離子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 開始沉淀 時的pH | 1.9 | 7.0 | — | — | 4.7 | — |
| 沉淀完全 時的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9(>9溶解) |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
寫出下列反應的化學方程式,并指出氧化劑和還原劑。
(1)鋰在空氣中燃燒
(2)鉀與水反應
(3)鎂條在二氧化碳氣體中燃燒
(4)曾青得鐵則化為銅——濕法煉銅
(5)從赤鐵礦中提煉鐵——工業冶鐵
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
(12分)接觸法制硫酸采用V2O5作催化劑,使用過的催化劑中含V2O5、VOSO4和SiO2,其中VOSO4能溶于水,從使用過的V2O5催化劑中回收V2O5的主要步驟是:向使用過的催化劑中加硫酸和Na2SO3浸取還原,過濾得VOSO4溶液;向濾液中加入KClO3氧化,再加入氨水生成沉淀;將沉淀焙燒處理后得V2O5。
(1) V2O5被浸取還原的反應產物之一是VOSO4,該反應的化學方程式為____。
(2) 若生產過程使用的硫酸用量過大,進一步處理時會增加________的用量。氨氣常用________檢驗,現象是________________________。
(3) 若取加入氨水后生成的沉淀(其摩爾質量為598 g·mol-1,且僅含有四種元素)59.8 g充分焙燒,得到固體殘留物54.6 g,同時將產生的氣體通過足量堿石灰,氣體減少了1.8 g,剩余的氣體再通入稀硫酸則被完全吸收。通過計算確定沉淀的化學式(寫出計算過程)。
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
KMnO4溶液常用作氧化還原反應滴定的標準液,由于KMnO4的強氧化性,它的溶液很容易被空氣中或水中的某些少量還原性物質還原,生成難溶性物質MnO(OH)2,因此配制KMnO4標準溶液的操作如下所示:①稱取稍多于所需量的KMnO4固體溶于水中,將溶液加熱并保持微沸1 h;②用微孔玻璃漏斗過濾除去難溶的MnO(OH)2;③過濾得到的KMnO4溶液貯存于棕色試劑瓶并放在暗處;④利用氧化還原滴定方法,用基準試劑(純度高、相對分子質量較大、穩定性較好的物質)溶液標定其濃度,KMnO4在滴定中被還原成Mn2+。請回答下列問題:
(1) 準確量取一定體積的KMnO4溶液需要使用的儀器是____________。
(2) 在下列物質中,用于標定KMnO4溶液的基準試劑最好選用________(填序號)。
| A.質量分數為30%的雙氧水 | B.FeSO4 | C.摩爾鹽 | D.Na2SO3 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com