
【題目】某探究小組在某溫度下,測得溶液的PH時發(fā)現(xiàn):0.01molL﹣1的NaHSO4溶液中,由水電離出的 C(H+)C(OH﹣)=10﹣20 . 在該溫度下,將V1 L PH=4的NaHSO4溶液與V2L PH=9的Ba(OH)2溶液混合(忽略溶液體積變化),所得溶液PH=7,則V1:V2等于( )
A.9:1
B.10:1
C.1:10
D.9:2
 開心快樂假期作業(yè)暑假作業(yè)西安出版社系列答案
開心快樂假期作業(yè)暑假作業(yè)西安出版社系列答案 名題訓練系列答案
名題訓練系列答案科目:高中化學 來源: 題型:
【題目】化學源于生活,在生產(chǎn)生活中,我們會遇到各種各樣的化學反應。
(1)今有鐵片、銅片, FeCl2 溶液 、 FeCl3 溶液、 CuSO4溶液, 設計實驗證明 Fe3+的氧化性比 Cu2+強, 寫出相應的化學方程式______________;
(2)野外作業(yè)中用于焊接鐵軌,該反應的化學方程式為______________;
(3)將一個鋁制易拉罐充滿 CO2氣體,然后往罐內注入足量的 NaOH 溶液,立即密封罐口,過一段時間后,罐壁內凹而癟,再過一段時間后又重新鼓起。 試用離子方程式解釋易拉罐又重新鼓起的原因______________;
(4)用小蘇打片(NaHCO3)治療胃酸(鹽酸)過多的離子方程式為______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有甲、乙兩位同學均想利用原電池反應檢測金屬的活動性順序,兩人均用鎂片和鋁片作電極,但甲同學將電極放入6 molL﹣1的H2SO4溶液中,乙同學將電極放入6 molL﹣1的NaOH溶液中,如圖所示.
(1)寫出甲中正極的電極反應式: .
(2)乙中負極為 , 總反應的離子方程式為 .
(3)如果甲同學與乙同學均認為“構成原電池的電極材料如果都是金屬,則構成負極材料的金屬應比構成正極材料的金屬活潑”,則甲會判斷出(填元素符號)的活動性更強,而乙會判斷出(填寫元素符號)的活動性更強.
(4)由此實驗得出的下列結論中,正確的有(填字母).
A.利用原電池反應判斷金屬活動性順序時應注意選擇合適的介質
B.鎂的金屬性不一定比鋁的金屬性強
C.該實驗說明金屬活動性順序已過時,沒有實用價值了
D.該實驗說明化學研究對象復雜、反應受條件影響較大,因此應具體問題具體分析.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述中能證明次氯酸是一種弱酸的是
A.次氯酸不穩(wěn)定,易分解
B.次氯酸是一種強氧化劑
C.次氯酸鈣能與碳酸作用生成碳酸鈣和次氯酸
D.次氯酸能使染料和有機色質褪色
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】進行下列化學基本量的計算,并將結果直接填入空格中。二氧化碳的摩爾質量是 _________,9g水的物質的量是________,0.5molO2在標準狀況下的體積約為_______________,約含有___________個氧原子。(NA表示阿伏加德羅常數(shù)的值).
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列框圖中的物質均為中學化學中常見物質,其中甲、乙為單質,其余均為化合物.B為常見液態(tài)化合物,A為淡黃色固體,F、G所含元素相同且均為氯化物,G遇KSCN溶液顯紅色.
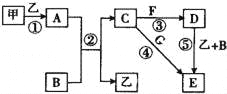
請回答下列問題:
(1)A是 .
(2)反應①~⑤中,屬于氧化還原反應的是 填序號).
(3)反應⑤的化學方程式為 ;甲與B反應的離子方程式為 .
(4)在空氣中將C溶液滴入F溶液中,觀察到的現(xiàn)象是 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定量的混合氣體在密閉容器中發(fā)生如下反應:mA(g)+nB(g)pC(g),在一定溫度下反應達到平衡,將容器容積縮小到原來的 ![]() ,當達到新的平衡時,C的濃度變?yōu)樵胶鈺r的1.9倍.若壓縮過程中溫度恒定,則下列說法中不正確的是( )
,當達到新的平衡時,C的濃度變?yōu)樵胶鈺r的1.9倍.若壓縮過程中溫度恒定,則下列說法中不正確的是( )
A.m+n<p
B.平衡向逆反應方向移動
C.C的體積分數(shù)增大
D.A的轉化率降低
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用石墨電極電解含有相同物質的量的Na2SO4和CuSO4的溶液。一段時間后,溶液顏色變淺。此時若要使溶液中的Na2SO4和CuSO4都恢復到電解前的濃度,應向電解后的溶液中加入適量的( )
A.Na2SO4和CuSO4
B.CuO
C.Na2O和CuO
D.H2O和CuSO4
查看答案和解析>>
國際學校優(yōu)選 - 練習冊列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com