
【題目】有關材料用途的說法中不正確的是( )。
A.氧化鋁陶瓷可用作高壓鈉燈的燈管
B.氮化硅陶瓷可用作陶瓷發動機的材料
C.光導纖維可用作遙測遙控、照明等
D.氧化鋁陶瓷可用作半導體材料
 口算題卡加應用題集訓系列答案
口算題卡加應用題集訓系列答案科目:高中化學 來源: 題型:
【題目】某溫度時在2L容器中X、Y、Z三種氣體物質的物質的量(n)隨時間(t)變化的曲線如下圖所示,由圖中數據分析: 
(1)該反應的化學方程式為:
(2)反應開始至2min,用Z表示的平均反應速率為
(3)下列敘述能說明上述反應達到化學平衡狀態的是(填序號)
A.混合氣體的總物質的量不隨時間的變化而變化
B.混合氣體的壓強不隨時間的變化而變化
C.單位時間內每消耗3mol X,同時生成2mol Z
D.混合氣體的總質量不隨時間的變化而變化.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】元素是構成我們生活的世界中一切物質的“原材料”.
(1)自18世紀以來,科學家們不斷探索元素之謎.通過從局部到系統的研究過程,逐漸發現了元素之間的內在聯系.下面列出了幾位杰出科學家的研究工作.
序號 | ① | ② | ③ | ④ |
科學家 | 紐蘭茲 | 道爾頓 | 德貝萊納 | 尚古爾多 |
工作 | 發現“八音律”,指出從某一指定的元素起,第八個元素是第一個元素的某種重復 | 創立 近代原子論,率先開始相對原子質量的測定工作 | 發現了5組性質相似的“三元素組”,中間元素的相對原子質量為前后兩種元素相對原子質量的算術平均值 | 認為 各元素組之間并非毫不相關,可以用相對原子質量把它們按從小到大的順序串聯 |
上述科學家的研究按照時間先后排序合理的是(填數字序號).
(2)1869年,門捷列夫在前人研究的基礎上制出了第一張元素周期表,如圖1所示. 
①門捷列夫將已有元素按照相對原子質量排序,同一(填“橫行”或“縱列”)元素性質相似.結合表中信息,猜想第4列方框中“?=70”的問號表達的含義是 , 第5列方框中“Te=128?”的問號表達的含義是 .
②到20世紀初,門捷列夫周期表中為未知元素留下的空位逐漸被填滿.而且,隨著原子結構的逐漸揭秘,科學家們發現了元素性質不是隨著相對原子質量遞增呈現周期性變化,而是隨著原子序數(核電荷數)遞增呈現周期性變化.其本質原因是(填字母序號).
A.隨著核電荷數遞增,原子核外電子排布呈現周期性變化
B.隨著核電荷數遞增,原子半徑呈現周期性變化
C.隨著核電荷數遞增,元素最高正化合價呈現周期性變化
(3)在現有的元素周期表中有A,B,D,E,X、Y、Z七種短周期元素.X與Y處于同一周期,Y的最高價氧化物的水化物與強酸、強堿均能反應.Z的單質常溫下為氣態,同條件下相對于氫氣的密度比為35.5.其余信息如圖2所示: ①上述七種元素中,處于第二周期的有(用元素符號表示,下同),X在周期表中的位置是 .
②E的原子結構示意圖為 , 寫出Z元素氣態氫化物的電子式: .
③B單質與E的最高價氧化物的水化物在一定條件下發生反應的化學方程式為;Y單質與X的最高價氧化物的水化物溶液反應的離子方程式為 .
④B和D的最高價氧化物的水化物的化學式分別為、 , 二者酸性前者(填“強于”或“弱于”)后者,原因是B和D的非金屬性有差異,利用原子結構解釋產生差異的原因: .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D、E均是短周期主族元素,其原子序數依次增大,A和B同周期,A和D同主族,A原子最外層電子數是內層電子數的二倍,B元素族序數是周期數的三倍,B的陰離子與C的陽離子電子層結構相同,C的單質與B的單質在不同條件下反應,可生成C2B或C2B2,E是所在周期中原子半徑最小的元素,請回答:
(1)D在元素周期表中的位置是___________。
(2)C2B2的電子式是________
(3)B、C、E的離子半徑由大到小的順序為________(用離子符號回答); A、D、E元素最高價氧化物對應水化物的酸性由強到弱為_________(用化學式回答,下同),B的氣態氫化物與H2S相比沸點高的是_____
(4)寫出D的氧化物與氫氟酸反應的化學方程式____________
(5)水中錳含量超標容易使潔具和衣物染色,使水產生異味,EB2可以用來除去水中超標的Mn2+,生成黑色沉淀MnO2,當消耗13.50g EB2時,共轉移了lmol電子,則反應的離子方程式__________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】目前工業上合成氨的反應原理為:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.4 KJ/mol
2NH3(g) ΔH=-92.4 KJ/mol
(1)在恒溫恒容條件下,向反應平衡體系中充入氮氣,達到新平衡時,c(H2)將______(填“增大”、“減小”、“不變”或“無法判斷”,下同),c(N2)·c(H2)將_______。
(2)下圖為合成氨反應在不同溫度和壓強、使用相同催化劑條件下,初始時氮氣、氫氣的體積比為1:3時,平衡混合物中氨的體積分數。若分別用VA(NH3)和VB(NH3)表示從反應開始至達平衡狀態A、B時的化學反應速率,則VA(NH3)_____VB(NH3)(填“>、“<”或“=")
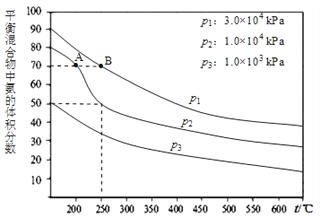
(3)①若恒溫恒壓下,在一容積可變的容器中,達到平衡狀態時,N2、H2、NH3各1mol,若此時再充入3molN2,則平衡____移動(“向正向“向逆向”“不”);
②若氮氣與氫氣以1:1混合反應時,達到平衡后,如果升高溫度氮氣的體積分數將____(“變大”“變小”不變”下同);如果增大壓強氮氣的體積分數將___。
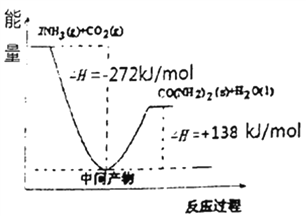
(4)H2NCOONH4是工業合成尿素的中間產物,該反應的能量變化如圖所示:用CO2和氨合成尿素的熱化學方程式為________。
(5)工業生產中逸出的氨可用稀硫酸吸收。若恰好生成NH4HSO4,該溶液中各離子的物質的量濃度由大到小的順序是__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用NA表示阿伏加德羅常數的值,下列說法正確的是
A. 2.4 g鎂原子變成離子時,失去的電子數為0.3NA
B. 常溫常壓下,28 g氮氣所含的原子數為2NA
C. 18 g H218O中含有的原子總數為3NA
D. 32 g氧氣和4 g氦氣所含原子數目相等,均為NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】閱讀表短周期主族元素的相關信息:
元素代號 | 相關信息 |
A | A的單質能與冷水劇烈反應,得到強堿性溶液 |
B | B的原子最外層電子數是其內層電子數的三倍 |
C | 在第3周期元素中,C的簡單離子半徑簡單最小 |
D | A、B、D組成的36電子的化合物X是家用消毒劑的主要成分 |
E | 所有有機物中都含有E元素 |
請回答:
(1)寫出E在元素周期表中的位置:;C的簡單離子的結構示意圖: .
(2)X的化學式為 .
(3)A,B,C三種元素的簡單離子的半徑由大到小的順序為(用離子符號表示).
(4)A,B兩元素組成的化合物A2B2屬于(填“離子”或“共價”化合物).
(5)C元素形成的單質能與A的最高價氧化物對應的水化物反應,其離子方程式為 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子方程式錯誤的是( )
A.氨氣通入稀硫酸 NH3+H+═NH4+
B.稀燒堿溶液和氯化銨溶液混合 NH4++OH﹣═NH3H2O
C.碳酸氫銨和足量濃燒堿溶液混合加熱 NH4++OH﹣═NH3↑+H2O
D.Cl2和水反應 Cl2+H2O═H++Cl﹣+HClO
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com