
【選修2:化學與技術】(15分)
空氣吹出法工藝,是目前“海水提溴”的最主要方法之一。其工藝流程如下:
(1)步驟④的離子反應方程式為 。
(2)溴微溶于水,步驟⑧中溴蒸氣冷凝后得到液溴與溴水的混合物,它們的相對密度相差較大。分離出液溴的實驗室方法為 。
(3)步驟⑥如果在實驗室中進行,需用到的玻璃儀器有 。
(4)工業生產不直接蒸餾含溴的海水得到液溴,而要經過“空氣吹出、SO2吸收、氯化”,原因是 。
(5)苦鹵水還可以用于制取金屬鎂,用化學方程式表示從苦鹵水制取金屬鎂的反應原理 。
(1)Br2 + SO2 + 2H2O === 4H+ + 2Br-+ SO42- (2分)(2)分液 (2分)
(3)酒精燈、蒸餾燒瓶、溫度計、冷凝管、尾接管、錐形瓶 (3分)
(4)①氯化后的海水雖然含有溴單質,但濃度低,如果直接蒸餾原料,產品成本高
②“空氣吹出、SO2吸收、氯化”的過程實際上是一個Br2的濃縮過程。(2分,
(5)MgCl2+Ca(OH)2 ="==" Mg(OH)2↓+CaCl2 (2分)2HCl+Mg(OH)2 ="==" MgCl2+2H2O (2分)
MgCl2(熔融)  Mg+Cl2↑(2分)
Mg+Cl2↑(2分)
解析試題分析:(1)步驟④的離子反應方程式為Br2 + SO2 + 2H2O === 4H+ + 2Br-+ SO42-;(2)溴微溶于水,步驟⑧中溴蒸氣冷凝后得到液溴與溴水的混合物,它們的相對密度相差較大。分離互不相溶的兩層液體物質的操作方法是分液;(3)步驟⑥如果在實驗室中進行,需用到的玻璃儀器有酒精燈、蒸餾燒瓶、溫度計、冷凝管、尾接管、錐形瓶;(4)工業生產不直接蒸餾含溴的海水得到液溴,而要經過“空氣吹出、SO2吸收、氯化”,原因是①氯化后的海水雖然含有溴單質,但濃度低,如果直接蒸餾原料,產品成本高;②“空氣吹出、SO2吸收、氯化”的過程實際上是一個Br2的濃縮過程。(5)苦鹵水還可以用于制取金屬鎂,用化學方程式表示從苦鹵水制取金屬鎂的反應原理是MgCl2+Ca(OH)2 ="==" Mg(OH)2↓+CaCl2;2HCl+Mg(OH)2 ="==" MgCl2+2H2O;MgCl2(熔融) Mg+Cl2↑。
Mg+Cl2↑。
考點:考查“海水提溴”的原理、操作等知識及苦鹵水制取金屬鎂的反應原理的方程式的表示的知識。


科目:高中化學 來源: 題型:單選題
下列金屬冶煉的反應原理,錯誤的是( )
A.2NaCl(熔融) 2Na+Cl2↑ 2Na+Cl2↑ | B.MgO+H2 Mg+H2O Mg+H2O |
C.Fe2O3+3CO 2Fe+3CO2 2Fe+3CO2 | D.2HgO 2Hg+O2↑ 2Hg+O2↑ |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列說法中,不正確的是
| A.用蒸餾法能從海水中提取淡水 |
| B.從海水中可以得到氯化鎂,再加熱分解可制金屬鎂 |
| C.用氯氣從海水中提溴的關鍵反應是Cl2+2Br-= 2Cl-+Br2 |
D.煤的氣化主要反應是 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
[化學選修——2:化學與技術](15分)
將海水淡化和與濃海水資源化結合起來是綜合利用海水的重要途徑之一。一般是先將海水淡化獲得淡水,再從剩余的濃海水中通過一系列工藝提取其他產品。
回答下列問題:
(1)下列改進和優化海水綜合利用工藝的設想和做法可行的是 (填序號)。
①用混凝法獲取淡水 ②提高部分產品的質量
③優化提取產品的品種 ④改進鉀.溴.鎂的提取工藝
(2)采用“空氣吹出法”從濃海水中吹出Br2,并用純堿吸收。堿吸收溴的主要反應是:Br2+Na2CO3+H2O  NaBr + NaBrO3+6NaHCO3,吸收1mol Br2時轉移的電子為 mol。
NaBr + NaBrO3+6NaHCO3,吸收1mol Br2時轉移的電子為 mol。
(3)海水提鎂的一段工藝流程如下圖:
濃海水的主要成分如下:
該工藝過程中,脫硫階段主要反應的離子方程式為 ,產品2的化學式為 ,1L濃海水最多可得到產品2的質量為 g。
(4)采用石墨陽極.不銹鋼陰極電解熔融的氯化鎂,發生反應的化學方程式為 ;電解時,若有少量水存在會造成產品鎂的消耗,寫出有關反應的化學方程式 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
目前世界上60%的鎂是從海水中提取的。海水提鎂的主要流程如下:
請回答下列問題:
(1)從離子反應的角度思考,在海水中加入石灰乳的作用是 ,寫出在沉淀池中發生反應的離子方程式 。
(2)石灰乳是生石灰與水形成的化合物,從充分利用海洋化學資源,提高經濟效益的角度,生產生石灰的主要原料來源于海洋中的 。
(3)操作A是 ,操作B是 。
(4)加入的足量試劑a是 (填化學式)。
(5)無水MgCl2在熔融狀態下,通電后會產生Mg和Cl2,該反應的化學方程式為 。從考慮成本和廢物循環利用的角度,副產物氯氣可以用于 。
(6)海水提鎂的過程,為什么要將海水中的氯化鎂轉變為氫氧化鎂,再轉變為氯化鎂?
_____________________________________________
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
我國有豐富的天然氣資源。以天然氣為原料合成尿素的主要步驟如下圖所示(圖中某些轉化步驟及生成物未列出):
請填寫下列空白:
(1)已知0.5 mol甲烷和0.5 mol水蒸氣在t ℃、p kPa時,完全反應生成一氧化碳和氫氣(合成氣),吸收了a kJ熱量。該反應的熱化學方程式是___________。
(2)上述流程中,工業上分離H2、CO2合理的方法是_____________________。
| A.混合氣先通入氫氧化鈉溶液,再在溶液中加鹽酸 |
| B.混合氣加壓冷卻,使CO2液化 |
| C.混合氣用氨水洗滌 |
| D.混合氣先通入到石灰漿,然后高溫煅燒固體 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
鋅錳廢電池經處理后,生產并回收硫酸鋅及碳酸錳,其中生產工業級碳酸錳工藝如下:
試回答下列問題:
(1)錳在元素周期表中位于第________周期,第________族。
(2)步驟1和步驟2是將MnO2轉化為MnO并溶于硫酸,其中步驟2中的氫氣,是另一個流程產生的副產品,請寫出產生氫氣的反應方程式__________________________。
(3)步驟3和步驟4都是除雜質。
①X是一種“綠色”氧化劑,則X是________(填化學式)。
②步驟3是除去雜質Fe2+。請用文字和必要的方程式簡述除去Fe2+的方法(已知三種離子沉淀的pH范圍為Fe3+:2.7~3.7,Mn2+:8.6~10.1,Fe2+:7.6~9.6)_________________________________________________________。
③步驟4中主要反應方程式為:MeSO4+BaS=MeS↓+BaSO4↓(Me主要為Pb、Cd、Hg等),則其除去雜質的原理是_________________________________________________。
(4)已知進行步驟5的操作時,溶液3(主要成分為MnSO4)會產生大量無色無味的氣泡,則步驟5反應的化學方程式為_______________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
丙酸的結構為CH3—CH2—COOH,丙酸鹽是安全有效的防霉、防腐劑,一種以堿式碳酸鋅為原料的生產工藝流程如下: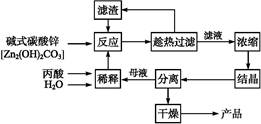
| 序號 | n(丙酸)∶ n(堿式碳酸鋅) | 反應溫度/℃ | 丙酸鋅產率/% |
| 1 | 1∶0.25 | 60 | 67.2 |
| 2 | 1∶0.25 | 80 | 83.5 |
| 3 | 1∶0.25 | 100 | 81.4 |
| 4 | 1∶0.31 | 60 | 89.2 |
| 5 | 1∶0.31 | 80 | 90.1 |
| 6 | 1∶0.31 | 100 | 88.8 |
 ,反應溫度 ℃。
,反應溫度 ℃。 查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com