
草木灰是一種農家肥,它的主要成分是碳酸鉀,還有硫酸鉀,氯化鉀等。化學興趣小組為測定某草木灰樣品中的有效成分,取50g草木灰于燒杯中,不斷滴入硫酸溶液,當滴入30g硫酸溶液時,不再有氣泡產生,此時燒杯中的殘余混合物的質量為77.8g。(假設草木灰的其他成分不含鉀元素且不與酸反應)
請計算回答:
(1)草木灰的主要成分所屬的物質類別為____________(填“酸、堿或鹽”)。
(2)如圖表示反應過程中放出的氣體質量與加入硫酸溶液的關系曲線,請求出圖中縱坐標上a點數值:a=________________g;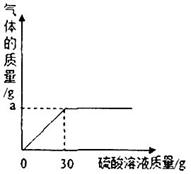
(3)計算草木灰樣品中碳酸鉀的質量分數。(要求寫出計算過程)
(4)通過其他實驗,測得該50g草木灰中還含的硫酸鉀質量為8.7g,氯化鉀的質量為1.49g,則該50g草木灰樣品中鉀元素的質量為__________g。
(1)鹽;(2)2.2(3)13.8%(4)8.58
解析試題分析:(1)根據題意可知,“草木灰是一種農家肥,它的主要成分是碳酸鉀,還有硫酸鉀,氯化鉀等”。其中的碳酸鉀,還有硫酸鉀,氯化鉀均是由金屬離子和酸根離子構成的化合物,屬于鹽類。
(2)a點表示生成氣體的質量的最大值。根據題意可知:該氣體為碳酸鉀與硫酸反應生成的二氧化碳氣體。其質量為:50g(草木灰)+30g(硫酸溶液)—77.8g(殘余混合物)="2.2" g。所以a="2.2" g;
(3)根據題意可知:已知量為生成二氧化碳的質量;未知量為樣品中碳酸鉀的質量分數。
解題思路:可根據二氧化碳與碳酸鉀在反應中的質量,求出碳酸鉀的質量,進一步求出其在樣品中的質量分數。具體過程如下:
解:設草木灰樣品中碳酸鉀的質量為x
K2CO3+H2SO4=K2SO4+CO2↑+H2O
138 44
x 2.2g
138:44=x:2.2g
解得:x=6.9g
碳酸鉀的質量分數=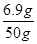 ×100%=13.8%
×100%=13.8%
答:草木灰樣品中碳酸鉀的質量分數為13.8%
(4)草木灰中的鉀元素是碳酸鉀、硫酸鉀和氯化鉀三種物質中的鉀元素的質量和。可分別根據三種物質的化學式求出其中所含鉀元素的質量。具體解題過程如下:
6.9g碳酸鉀(K2 CO3)中含鉀元素的質量為:6.9g×(
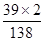 ×100%)=3.9g;
×100%)=3.9g;
8.7g硫酸鉀(K2 SO4)中含鉀元素的質量為:8.7g×(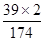 ×100%)=3.9g;
×100%)=3.9g;
1.49g氯化鉀(KCl)中含鉀元素的質量為:1.49g×(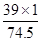 ×100%)=0.78g;
×100%)=0.78g;
草木灰樣品中鉀元素的質量為3.9g+3.9g+0.78g=8.58g。
考點:綜合計算


科目:初中化學 來源: 題型:計算題
100克某濃度的硫酸恰好與13克的鋅完全起反應,請計算:
(1)生成氫氣的質量(結果精確到0.1g).
(2)將(1)的結果標在圖中;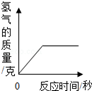
(3)反應后所得溶液中溶質的質量分數(寫出計算過程,結果精確到0.1%).
查看答案和解析>>
科目:初中化學 來源: 題型:計算題
(5分)某校課外活動小組的同學在測定由MgCl2和NaCl組成的固體混合物的組成時,進行了如下實驗。取20克固體配成200克溶液,平均分成四份,然后分別加入一定質量分數的NaOH溶液,所得實驗數據見下表:
| | 實驗一 | 實驗二 | 實驗三 | 實驗四 |
| 固體混合物溶液的質量/g | 50 | 50 | 50 | 50 |
| 加入NaOH溶液的質量/g | 10 | 20 | 30 | 40 |
| 生成沉淀的質量/g | 1 | m | 2.9 | 2.9 |
查看答案和解析>>
科目:初中化學 來源: 題型:計算題
(7分) 工業上常用稀鹽酸處理鐵制品表面的鐵銹,據此請回答下列問題:
(1)除去鐵銹的過程中還可以看到的一項實驗現象是______________________________;
(2)如果稀鹽酸用量太多就會看到有氣泡產生,用化學方程式說明原因:
____________________________________________;
(3)工業上用了30千克溶質質量分數為7.3%的稀鹽酸,與某鐵制品表面的鐵銹恰好完全反應,求反應后溶液的質量。(計算結果精確到小數點后一位)
查看答案和解析>>
科目:初中化學 來源: 題型:計算題
某公司生產出的純堿產品中經檢測只含有氯化鈉雜質。為測定產品中碳酸鈉的質量分數,20℃時,稱取該產品樣品26.5g,加入到盛有一定質量稀鹽酸的燒杯中,碳酸鈉與稀鹽酸恰好完全反應,氣體完全逸出,得到不飽和NaCl溶液。反應過程用精密儀器測得燒杯內混合物的質量(m)與反應時間(t)關系如下圖所示。
求:(1)生成CO2的質量。
(2)反應后所得溶液中NaCl的質量分數。
查看答案和解析>>
科目:初中化學 來源: 題型:計算題
(6分)在鐵路建設中,常利用下列反應實現鋼軌對接:Fe2O3 + 2Al 高溫 2Fe + Al2O3 。若建設中需要56kg的鐵,則消耗鋁粉的質量是多少?
查看答案和解析>>
科目:初中化學 來源: 題型:計算題
某補鈣劑的主要成分是碳酸鈣。為測定該補鈣劑中碳酸鈣的質量分數,某同學稱取一定質量的樣品放在燒杯里,向其中加入稀鹽酸至不再產生氣泡為止,過濾,得到濾渣2.5g;同時得到濾液100克,經測定得濾液的溶質質量分數為 11.1%。計算:
(1)該補鈣劑中碳酸鈣的質量分數?
(2)某人除正常飲食之外,每天需補充0.64g鈣元素,則每天需要服用這種補鈣劑多少克?
(3)若將所得到的濾液的溶質質量分數減小一半,應加水多少克?
查看答案和解析>>
科目:初中化學 來源: 題型:計算題
(9分)某硫酸廠廢水中含有少量硫酸.排放前,技術員小張先對廢水中硫酸的含量進行檢測。
(1)配制溶液:
欲配制溶質質量分數為4%的NaOH溶液100g,需要NaOH固體 g,水 ml
(水的密度為1 g/CI113);
(2)檢測分析:
取廢水樣品98g,向其中逐滴加入NaOH溶液至恰好完全反應時,消耗4%的NaOH
溶液20g(假設廢水中其它成分均不和NaOH反應)。試計算廢水中硫酸的質量分數
(寫出計算過程)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com