
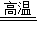 Cu+CO2,CO奪得氧生成CO2,CuO失去氧生成Cu,因此固體質量減少量為參加反應的氧化銅失去的氧的質量.依據題意還知道收集到的CO2 的質量,所以計算銅的質量時,可以根據氧元素的質量和氧化銅的化學式進行計算,也可根據CO2的質量和化學方程式進行計算.
Cu+CO2,CO奪得氧生成CO2,CuO失去氧生成Cu,因此固體質量減少量為參加反應的氧化銅失去的氧的質量.依據題意還知道收集到的CO2 的質量,所以計算銅的質量時,可以根據氧元素的質量和氧化銅的化學式進行計算,也可根據CO2的質量和化學方程式進行計算.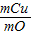 =
=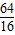 =
=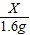
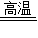 Cu+CO2
Cu+CO2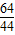 =
=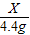


 暑假作業暑假快樂練西安出版社系列答案
暑假作業暑假快樂練西安出版社系列答案科目:初中化學 來源:2009年四川省眉山市中考化學試卷(解析版) 題型:解答題
| 主要成分(mg/L): 碳酸氫根(HCO3-):173-205 氯離子(Cl-):1.0-8.0 硫酸根(SO42-):16.08 -19.52 鈉離子(Na+):8-50 PH值:7.8±0.5 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com